L’infertilité touche entre un tiers et un quart des couples dans le monde. La part masculine représente plus de la moitié des cas des échecs d’AMP. En plus de l’analyse du spermogramme, l’étude de la structure de l’ADN spermatique est essentielle dans l’évaluation des causes d’infertilité. En effet, la fragmentation de l’ADN spermatique est impliquée dans les échecs répétés d’AMP (Spano et al., 2000; Saleh et al., 2003). La structure finale de la chromatine spermatique est dépendante de deux mécanismes post-translationnels: la méthylation et l’acétylation. La méthylation est à la fois impliquée dans la stabilité de l’ADN spermatique et dans l’acquisition de marqueurs épigénétiques.
Une corrélation importante a été démontrée entre les erreurs de méthylation et le stress oxydatif, avec un impact négatif sur la qualité spermatique (Aston et al., 2015; Menezo et al., 2016).
Le gène MTHFR code pour une enzyme intervenant dans le 1-carbon-cycle et jouant de ce fait un rôle dans le stress oxydant. Le variant C677T du gène MTHFR diminue l’activité de l’enzyme d’un tiers chez les patients hétérozygotes et de deux tiers chez les patients homozygotes.
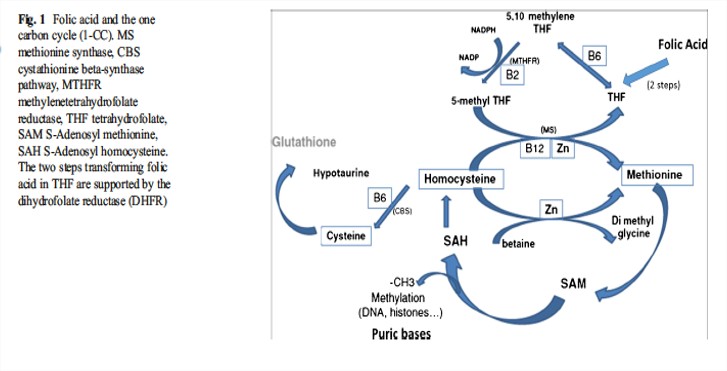
Plusieurs méta-analyses ont montré que les polymorphismes du gène de la MTHFR étaient associés avec l’infertilité masculine (Gong et al., 2015; Yang et al., 2016).
L’objectif de notre étude était d’étudier l’effet de l’isoforme C677T sur la structure de l’ADN spermatique.
L’analyse des polymorphismes du gène MTHFR a été effectuée par PCR temps réel. Les hommes atteints de la mutation C677T du gène de la MTHFR sont inclus dans l’étude pour analyse de la fragmentation et de la décondensation de l’ADN spermatique. Ils sont également comparés à une population générale de patients.
La fragmentation et la décondensation ont été respectivement analysées par un protocole SCSA® modifié (Sperm Chromatin Structure Assay) et HDS (High DNA Stainibility) (Hamidi J et col 2015). Dans notre cohorte, 77 patients sont porteurs de la mutation à l’état hétérozygote et 18 patients à l’état homozygote. Les fragmentations et décondensations sont comparées à une population contrôle de 1417 hommes.
La décondensation est augmentée dans les deux populations homozygote (p=0.0006) et hétérozygote (p=0.029) par rapport à la population contrôle. La fragmentation n’est pas augmentée chez les patients homozygotes et hétérozygotes. Les polymorphismes du gène de la MTHFR, en entrainant une diminution d’activité de l’enzyme, pourrait altérer la qualité de l’ADN spermatique et en particulier augmenter sa décondensation.
Chez les patients ayant des altérations de l’ADN spermatique, il apparait donc important de rechercher ces polymorphismes du gène de la MTHFR. En effet, traiter ces patients présentant une mutation, avec du 5 methyl THF, produit de l’activité MTHFR, pourrait réguler le stress oxydatif, améliorer la qualité de l’ADN spermatique et in fine, leurs résultats en AMP.
Dans une étude multicentrique en cours de publication menée chez 30 couples ayant subi entre 2 et 7 échecs d’AMP et/ou entre 3 et 9 FCS et dont un des deux membres est porteur du polymorphisme du gène de la MTHFR, nous avons montré que traiter les patients porteurs par du 5 methyl THF avait permis d’obtenir 14 grossesses évolutives sur 30 cycles avec un taux de grossesse clinique évolutive par transfert de plus de 50%.
Références
Association between the MTHFR-C677T isoform and structure of sperm DNA.
Cornet D, Cohen M, Clement A, Amar E, Fournols L, Clement P, Neveux P, Ménézo Y.
J Assist Reprod Genet. 2017 Aug 25. doi: 10.1007/s10815-017-1015-2
Sperm chromatin damage impairs human fertility. The Danish First Pregnancy Planner Study Team.
Spanò M, Bonde JP, Hjøllund HI, Kolstad HA, Cordelli E, Leter G.
Fertil Steril. 2000 Jan;73(1):43-50
Oxidative stress and male infertility: from research bench to clinical practice.
Saleh RA, Agarwal A. J Androl. 2002 Nov-Dec;23(6):737-52
Aberrant sperm DNA methylation predicts male fertility status and embryo quality.
Aston KI, Uren PJ, Jenkins TG, Horsager A, Cairns BR, Smith AD, Carrell DT.
Fertil Steril. 2015 Dec;104(6):1388-97.e1-5. doi: 10.1016/j.fertnstert.2015.08.019. Epub 2015 Sep 8
Oxidative stress and alterations in DNA methylation: two sides of the same coin in reproduction.
Menezo YJ, Silvestris E, Dale B, Elder K.
Reprod Biomed Online. 2016 Dec;33(6):668-683. doi: 10.1016/j.rbmo.2016.09.006. Epub 2016 Sep 27
Gong M, Dong W, He T, Shi Z, Huang G, Ren R, Huang S, Qiu S, Yuan R.
PLoS One. 2015 Mar 20;10(3):e0121147. doi: 10.1371/journal.pone.0121147
Yang Y, Luo YY, Wu S, Tang YD, Rao XD, Xiong L, Tan M, Deng MZ, Liu H.
Genet Mol Res. 2016 Apr 26;15(2). doi: 10.4238/gmr.15027631
Hamidi J, Frainais C, Amar E, Bailly E, Clément P, Ménézo Y.
Zygote. 2015 Aug;23(4):556-62. doi: 10.1017/S0967199414000288. Epub 2014 Jul 3
_________________________________
Vous pourrez trouver plus d’information sur l’auteur à l'adresse : www.laboclement.com



