1. Généralités
Le diagnostic de l’endométriose est évoqué devant des dysménorrhées, des dyspareunies profondes, une dysurie, une dyschésie, des rectorragies douloureuses ou une hématurie, des scapulalgies, un pneumothorax cataménial, une toux/hémoptysie/douleurs thoraciques cycliques, une fatigue chronique et une infertilité (1).
Il s’agit d’une pathologie bénigne qui toucherait 3 % de la population générale et environ 10 % des femmes en âge de procréer (1). Son incidence serait de 40 % des femmes infertiles (1).
Depuis la publication de la stratégie nationale de lutte contre l’endométriose par le Président Emmanuel Macron en 2021, le diagnostic précoce est la pierre angulaire du parcours de soins filiarisé (médical et paramédical) coordonnée, et personnalisée mis en place progressivement par les ARS (Agences Régionales de Santé)(2).
Dans cet article, nous proposons une synthèse de la stratégie diagnostique actuelle conformément aux recommandations françaises et européennes, avant d'examiner la place du diagnostic salivaire de l’endométriose.
Nous présentons une proposition d’algorithme diagnostique hiérarchisé et pratique devant une suspicion d'endométriose intégrant le test salivaire (3).
2. Recommandations Européennes de diagnostic de l’endométriose et problématique clinique
Depuis les recommandations européennes de l’ESHRE 2022 (4) et de la Haute Autorité de Santé en 2017 en cas de suspicion d’endométriose, il est préconisé de réaliser une imagerie pelvienne (échographie et/ou une IRM).
Cette stratégie diagnostique par imagerie est complémentaire un temps d’anamnèse +/- de questionnaire d’endométriose standardisé +/- un examen clinique (4,5). Elle est particulièrement efficace pour les formes profondes de la maladie et étendue et pour les formes kystiques ou endométriomes.
Cependant, quel que soit le pays ou le système de santé, ce diagnostic est associé à une errance de 7 à 10 ans. Cette errance a pour conséquence : une altération de qualité de vie personnelle familiale et professionnelles, une chronicisation de la douleur, l’absence de prévention de l’infertilité, et un certain fatalisme pour de nombreuses patientes. De plus, ce délai au diagnostic induit ou aggrave le stress, et le sentiment d’isolement et d’incompréhension des patientes et oblige souvent les patientes à trouver d’elles-mêmes des solutions à visée analgésiques (6).
Enfin, ces mêmes recommandations soulignent devant une discordance clinico-radiologique (patiente symptomatique avec un examen clinique et une imagerie normale) de discuter en réunion de concertation pluridisciplinaire la réalisation d’une coelioscopie diagnostique. La coelioscopie diagnostique est principalement réservée aux formes précoces de la maladie (atteinte superficielle péritonéale) en raison de la difficulté de détection avec les outils d’imagerie actuellement.
Ces formes superficielles isolées sont par ailleurs les plus fréquentes entre 18 et 25 ans, elles ont la particularité d’être plus algique et sont associées au risque d’infertilité (7).
En vie réelle, la problématique de la coelioscopie diagnostique représenterait d’après les données de l’association ENDOFRANCE près de 25% des situations diagnostiques (2).
3. Performance des outils diagnostics actuels
Dans ce contexte gardons à l’esprit que la problématique du diagnostic dans l’endométriose est majeure car elle concerne une maladie (i) dont il existe une grande variété de symptômes et de présentation anatomoclinique (forme superficielle, forme profonde, forme mixte, kyste ovarien), (ii) dont la prévalence estimée est de 10 à 15% de la population générale, (iii) dont les formes précoces (formes superficielles péritonéales) seraient les plus fréquente (entre 50 et 60%), (iv) dont les formes les plus fréquentes et les plus algiques ne sont pas ou peu accessibles aux à la résolution des outils diagnostic disponibles.
Les conclusions de la revue de la littérature de Pascoal et coll (8) soulignent la nécessité d'utiliser une combinaison de méthodes diagnostiques en raison de leur performance intrinsèque, y compris la coelioscopie, pour améliorer l'efficacité de la prise en charge diagnostique globalement (2). Notons au passage que même la chirurgie ne permet pas de résoudre totalement la question du diagnostic avec certitude.
Tableau 1 : Synthèse des performances des outils diagnostics rapportées par Pascoal et coll (10).
|
Examen |
Performance statistique diagnostique |
Bénéfice |
Limites |
|
L’interrogatoire |
Se : 76 – 98% Sp : 20 – 58% |
Simple Accessible facilement A faible cout |
Ne précise pas l’étendue des lésions Présente une faible spécificité, les symptômes de l’endométriose pouvant être compatibles avec plusieurs diagnostiques différentiels. |
|
L’examen physique |
Se : 18 – 88% Sp : 76 – 100%, |
Spécificité en cas de diagnostic direct de lésions par l’inspection ou la palpation de nodules d’endométriose ou d’induration sensibles. |
Faible sensibilité Très opérateur dépendant Incapable de faire le diagnostic des lésions superficielles par exemple |
|
L’échographie |
Endométriose superficielle : Se : 65 – 79% Sp : 91 – 95%
Endométriomes : Se : 93% Sp : 96%
Endométriose profonde : Se : 79% Sp : 94% |
Performances très élevées pour le diagnostic des endométriomes et de l’endométriose sévère avec atteinte colorectale Faible coût Grande accessibilité Possibilité d’un examen dynamique mobilisant et palpant les organes |
Limitée pour la détection des formes superficielles A des performances très dépendantes de l’opérateur et de son expertise |
|
L’IRM |
Endométriose superficielle : Se : 79% Sp : 72%
Endométriome : Se : 95% Sp : 91%
Endométriose profonde : Se : 94% Sp : 77% |
Meilleures performances pour détecter l’endométriose profonde et les atteintes extra-pelviennes Permets la relecture par des radiologues experts et discussion en réunion si besoin |
Performances pour la détection de l’endométriose superficielle restent limitées. Le coût de l’examen reste significatif. |
4. Qu’est-ce que le test salivaire de diagnostic de l’endométriose
Le test diagnostic de l’endométriose présente la particularité de s’intéresser à la salive comme fluide d’intérêt avec la détection puis la quantification de biomarqueurs comme les micro-ARNs. Ces biomarqueurs ont été associée pour déterminer une signature diagnostique sensible et spécifique à l’aide d’un modèle d’intelligence artificielle.
- Les miARN c’est quoi ? (9)
Ce sont de petits ARNs intracellulaires longs de 22 nucléotides qui sont capables d’induire l’extinction (silencing) de l’expression de gènes par des mécanismes de régulations post-transcriptionnelles, en se fixant de manière ciblée aux parties 3’ non traduites (3’UTR) des mARNs en provoquant un blocage de la traduction ou la dégradation de ceux-ci. Ce mécanisme n’est cependant pas exclusif ; la fixation de miARNs sur les régions 5’UTR est aussi possible et induit alors, soit une activation, soit une répression de la traduction.
La figure 1 : résume les mécanismes de la biosynthèse des miARNs.
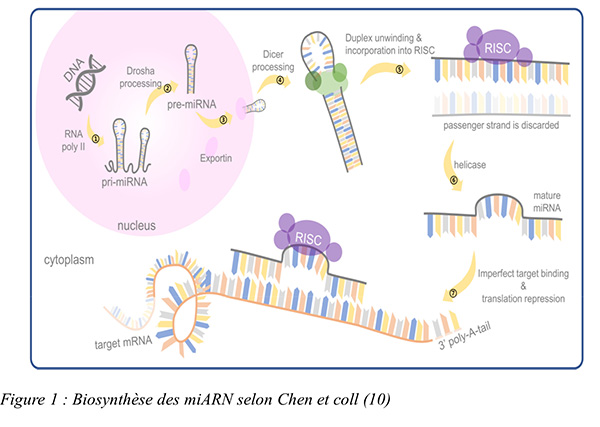
5. Comment a t’il été développé ?
L’étude ENDO-miARN (ClinicalTrials.gov Identifier: NCT04728152) est réalisée sur 200 patientes. Elle avait permis d’identifier une signature salivaire comportant 109 microARNs. La sensibilité, la spécificité et l'aire sous la courbe (AUC) respectives pour la signature mi ARN salivaire étaient de 96,7 %, 100 % et 98,3 % (10,11).
L’étude « ENDOmiRNA Saliva Test study » (ClinicalTrials.gov (NCT05244668) (14) avait pour objectif de réaliser une validation clinique de la performance et de la reproductibilité du test salivaire de diagnostic de l’endométriose. Les points clés des résultats (en analyse intérimaire) sont la confirmation et la validation de la performance avec une sensibilité, une spécificité supérieure à 95% ;
Le bénéfice d’un test salivaire est surtout intéressant pour le diagnostic biologique des formes précoces :
Compte tenu des performances diagnostiques plusieurs hypothèses peuvent être envisagées pour ces formes précoces survenant le plus souvent dès l’adolescence :
- La réduction du nombre de chirurgie diagnostique
- La réduction du délai diagnostique
- La réduction des actes d’imagerie diagnostique en cas de discordance clinico-radiologique
- Une prise en compte précocement des symptômes et de la qualité de vie afin d’en réduire la chronicisation
Limites du test salivaire (12).
- L’absence de renseignement apporté par le test sur le phénotype clinique ou anatomoclinique de la maladie mais il ouvre une réflexion scientifique sur la définition biologique du phénotype moléculaire de l’endométriose
- Par ailleurs, bien qu'aucune différence n'ait été observée dans l'expression des miARN entre les patientes atteintes de dysménorrhée inférieure ou supérieure à l'EVA 7, sa valeur théranostique est limitée.
6. Place du test salivaire dans la prise en charge diagnostique en cas de suspicion d’endométriose (13).
Sur la base des recommandations nous proposons l’algorithme décisionnel suivant devant une suspicion d’endométriose intégrant le test salivaire (Figure 1).
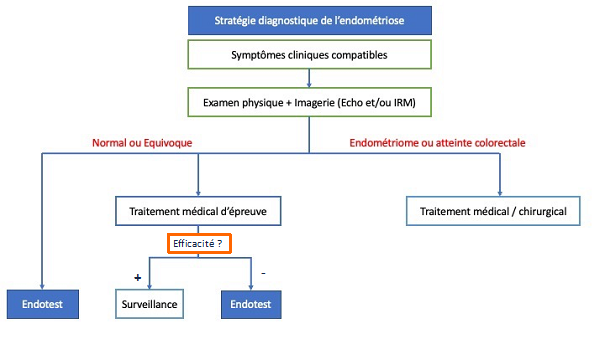
Figure 1 : Algorithme décisionnel suivant devant une suspicion d’endométriose.
7. Conclusion
La HAS recommande l'utilisation du test dans les situations complexes, notamment (14) :
- Lorsque les examens cliniques et d'imagerie (échographie ou IRM) sont normaux ou équivoques.
- En cas de persistance des symptômes malgré un traitement médical bien conduit.
La HAS propose un accès précoce via le forfait innovation afin d'évaluer l'impact du test sur la prise en charge des patientes. Cette approche permettra d'accumuler davantage de données cliniques avant une éventuelle généralisation ou prise en charge pérenne.
En pratique, le test sera disponible en France dans 80 centres de niveau 1 et 2 à partir de février 2025.
Références
- Zondervan KT, Becker CM, Koga K, Missmer SA, Taylor RN, Viganò P. Endometriosis. Nat Rev Dis Primer. 19 juill 2018;4(1):9.
- Candau Y, Estrade DJP, Roman PH. endoVie VIVRE AVEC L’ENDOMÉTRIOSE : PLUS DE 1 550 FEMMES EN PARLENT.
- Bendifallah S, Dabi Y, Suisse S, Delbos L, Spiers A, Poilblanc M, et al. Validation of a Salivary miRNA Signature of Endometriosis — Interim Data. NEJM Evid [Internet]. 27 juin 2023 [cité 1 oct 2023];2(7). Disponible sur: https://evidence.nejm.org/doi/10.1056/EVIDoa2200282
- members of the Endometriosis Guideline Core Group, Becker CM, Bokor A, Heikinheimo O, Horne A, Jansen F, et al. ESHRE guideline: endometriosis. Hum Reprod Open. 2022;2022(2):hoac009.
- Chapron C, Lafay-Pillet MC, Santulli P, Bourdon M, Maignien C, Gaudet-Chardonnet A, et al. A new validated screening method for endometriosis diagnosis based on patient questionnaires. eClinicalMedicine. févr 2022;44:101263.
- Schwartz ASK, Gross E, Geraedts K, Rauchfuss M, Wölfler MM, Häberlin F, et al. The use of home remedies and complementary health approaches in endometriosis. Reprod Biomed Online. févr 2019;38(2):260‑71.
- Reis FM, Santulli P, Marcellin L, Borghese B, Lafay-Pillet MC, Chapron C. Superficial Peritoneal Endometriosis: Clinical Characteristics of 203 Confirmed Cases and 1292 Endometriosis-Free Controls. Reprod Sci. janv 2020;27(1):309‑15.
- Pascoal E, Wessels JM, Aas‐Eng MK, Abrao MS, Condous G, Jurkovic D, et al. Strengths and limitations of diagnostic tools for endometriosis and relevance in diagnostic test accuracy research. Ultrasound Obstet Gynecol. sept 2022;60(3):309‑27.
- Panir K, Schjenken JE, Robertson SA, Hull ML. Non-coding RNAs in endometriosis: a narrative review. Hum Reprod Update. 2018 Jul 1;24(4):497-515.
- Bendifallah S, Dabi Y, Suisse S, Jornea L, Bouteiller D, Touboul C, et al. MicroRNome analysis generates a blood-based signature for endometriosis. Sci Rep. 8 mars 2022;12(1):4051.
- Bendifallah S, Suisse S, Puchar A, Delbos L, Poilblanc M, Descamps P, et al. Salivary MicroRNA Signature for Diagnosis of Endometriosis. J Clin Med. janv 2022;11(3):612.
- Ferrier C, Bendifallah S, Suisse S, Dabi Y, Touboul C, Puchar A, et al. Saliva microRNA signature to diagnose endometriosis: A cost‐effectiveness evaluation of the Endotest®. BJOG Int J Obstet Gynaecol. mars 2023;130(4):396‑406.
- Nisenblat V, Bossuyt PM, Farquhar C, Johnson N, Hull ML. Imaging modalities for the non-invasive diagnosis of endometriosis. Cochrane Gynaecology and Fertility Group, éditeur. Cochrane Database Syst Rev [Internet]. 26 févr 2016 [cité 1 oct 2023];2016(2).
- Haute Autorité de Santé (HAS). (2024). Avis favorable à l’octroi d’un forfait innovation pour le test salivaire Endotest®. HAS Rapport d’évaluation.



