Introduction
Une mise au point à propos de la place de la Metformine dans le domaine de l’infertilité parait justifiée car cette molécule a été introduite dans la pharmacopée il y a plus de 60 ans, à une époque où les exigences scientifiques n’étaient pas celles d’aujourd’hui tant en termes d’efficacité que de sécurité. De nombreuses données complémentaires concernant la pharmacocinétique, les mécanismes d’action de cette molécule étaient donc indispensables et lui ont permis d’être, à ce jour, la1ère molécule utilisée dans le monde pour le diabète de type 2. De plus, la découverte des très nombreux impacts de cette molécule a permis d’étendre ses indications au syndrome métabolique (dyslipidémies, pathologies cardiovasculaires), à la prévention de certains cancers et aux effets du vieillissement. De ce fait, la metformine trouve une place toute particulière chez les patientes atteintes de Syndrome des Ovaires Polykystiques (SOPK) qui cumulent nombre de ces risques.
Historique
L’introduction de la Metformine dans la Pharmacopée ne date pas d’hier ! En effet, au Moyen Age déjà, on savait qu’une plante médicinale, Galega officinalis, nommée aussi « lilas français » (Figure 1), avait pour vertu de soigner chez l’homme certaines manifestations (polyurie) du diabète sucré.

Figure 1 : Galega officinalis
En 1914, un pharmacien français, Charles Tannet, isole le principe actif de cette plante qu’il dénomme Galégine, très proche d’une molécule simple, la guanidine, connue pour ses effets hypoglycémiants mais toxique pour l’homme. La Metformine, issue de 2 molécules de guanidine, est développée en 1922 par 2 irlandais mais leurs travaux sont occultés par les débuts de l’utilisation de l’insuline. Ce n’est que dans les années 1950 que les premiers essais cliniques de cet agent antidiabétique oral sont réalisés par Jean Sterne, un médecin pharmacologue français. A la suite de ces travaux, la metformine est commercialisée en 1959 sous le nom évocateur de Glucophage (qui mange le sucre) par les laboratoires Aron puis Merck.
Depuis cette date, la metformine est, en l’absence de contre-indications, le traitement oral de choix du diabète de type 2 à instaurer parallèlement aux mesures hygiéno-diététiques (Consensus de 2006 de l’American Diabetes Association et de l’European Association for the Study of Diabetes, mis à jour en 2009) (1-2). Récemment, une méta-analyse a confirmé sa place essentielle dans cette indication (3).
Mécanismes d’action
La Metformine est un antidiabétique oral dont le mode d’action est resté longtemps imprécis. A la date d’aujourd’hui, il est admis que
- Son effet hypoglycémiant résulte d’une réduction de la gluconéogénèse hépatique entrainant une baisse de la production hépatique de glucose. Une équipe de recherche de Grenoble fut la première à mettre en évidence, en 2000, que la Metformine induit une inhibition de la chaine respiratoire mitochondriale (Complexe I du système OXPHOS) (4)
- Du fait de la déplétion énergétique cellulaire secondaire à l’inhibition de la chaîne respiratoire, la Metformine augmente l’activité d’une enzyme hépatique (l’AMP kinase) qui améliore la sensibilité à l’insuline et diminue le risque de stéatose hépatique.
- Un effet propre de la Metformine au niveau intestinal a été également mis en évidence : augmentation de la consommation du glucose via la stimulation de la production du Glucagon-like peptide 1 (GLP-1) et, surtout, une modification de la flore intestinale. (5)
- Enfin, tout récemment, il a été rapporté qu’une augmentation du GDF 15 peut être observée chez les patientes qui répondent favorablement à la prise de Metformine (6). Ce peptide hormonal, produit par les cellules en situation de stress pour réguler l’apport alimentaire et la dépense énergétique via un récepteur cérébral (7), pourrait devenir un des biomarqueurs d’efficacité de la Metformine car son taux sérique est bien corrélé à l’importance de la perte de poids.
Pharmacogénétique
De nombreux gènes codent pour des protéines impliquées dans l’absorption, la diffusion tissulaire, le métabolisme et l’élimination des médicaments. D’une façon générale, les polymorphismes génétiques expliquent la variabilité d’action interindividuelle d’un composé. C’est le cas de la Metformine dont les transporteurs OCT1 et OCT2 facilitent le transport et la diffusion. Ainsi, a-t-on pu identifier certains polymorphismes, notamment dans le gène codant OCT1, qui entraînent une réduction de l’effet hypoglycémiant de la metformine (8). Ils pourraient également expliquer les différences interindividuelles de tolérance à la Metformine (nausées, diarrhée) attribuées à des concentrations intestinales différentes (5).
Indications
Outre sa prescription pour le traitement du Diabète de type 2, de nombreuses études ont établi son intérêt potentiel dans d’autres domaines :
- Le surpoids et l’obésité : La Metformine est, en général, associée à une réduction pondérale à long terme parallèle à l’amélioration des taux de glycémie. Elle est souvent modeste (1.1 kg) (9), supérieure chez les patientes en simple surpoids (3.5% de l’IMC) et devient significative chez des patients dont l’IMC est supérieur à 35 (10). Cependant, l’analyse de l’IMC n’est probablement pas le marqueur idéal des effets de la Metformine. L’adiposité abdominale, mesurée par le tour de taille au niveau ombilical, est certainement le mode d’évaluation le plus pertinent car bien mieux corrélé au degré d’insulino-résistance. Toutefois, les effets bénéfiques de la Metformine ne se limitent pas à la réduction de l’insulino-sécrétion mais relèvent également de ses effets gastro-intestinaux : nausées, diarrhées liées à la prise de Metformine, modification de la flore intestinale (microbiote), modulation des centres régulateurs hypothalamiques de l’appétit participent à la perte pondérale.
- Les pathologies cardio-vasculaires et la mortalité associée. Les effets bénéfiques de la metformine sur le risque d’infarctus (-39%) et de décès liés au diabète (-42%) ont été confirmés sur une période de 10 ans (11). Ils sont attribués à son effet sur la masse graisseuse, le profil lipidique et la constitution de la plaque d’athérome (12)
- Les propriétés anti-cancéreuses : le diabète de type 2 favorisant le risque de cancer, l’impact de la metformine a été particulièrement étudié. Une étude pilote de 12.000 patientes diabétiques a montré une réduction significative de la mortalité chez les patientes traitées par metformine et proportionnelle à la durée d’administration (13). Le risque de cancer (prostate, pancréas et sein) est significativement diminué (14). Cet effet de la Metformine semble être la conséquence de l’activation de l’’AMPK qui, d’une part, aide à la correction de l’hyperinsulinisme, d’autre part induit une réduction de la consommation d’énergie par les cellules néoplasiques. Une certaine synergie semble exister entre la Metformine et la chimiothérapie (15)
- Effets sur les conséquences de l’âge et le déclin cognitif. Les effets tissu-spécifiques de la metformine sur l’expression de gènes métaboliques et non métaboliques impliqués dans le vieillissement sont également attribués à son effet inhibiteur de la chaine respiratoire (16). Par ailleurs, certains arguments plaident en faveur d’un effet protecteur de la metformine sur le risque de démence (17). Cependant, pas de consensus selon l’ensemble des études publiées, en général rétrospectives, ni mécanisme d’action encore hypothétique.
Le schéma ci-dessous (Figure 2) décrit les différents effets de la Metformine (18)
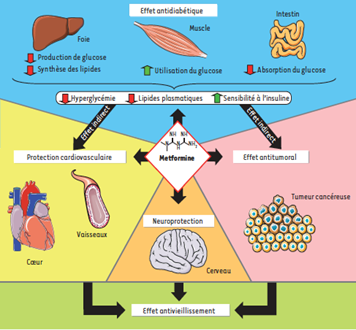
Figure 2. Résumé des principaux effets de la metformine. La metformine exerce ses effets antidiabétiques principalement au niveau du foie par l’inhibition de la gluconéogenèse et, dans une moindre mesure, au niveau de l’intestin et du muscle, pour aboutir à une diminution de l’hyperglycémie et des lipides circulants, ainsi qu’à une augmentation de la sensibilité à l’insuline. Ces améliorations procurent de manière indirecte une protection cardiovasculaire et un effet anti tumoral. De plus, la metformine réduit de manière directe le risque de maladies cardiovasculaires par des actions affectant à la fois les systèmes macro- et micro-vasculaires, et produit une action anti tumorale directement sur les cellules cancéreuses.
Par ailleurs, la metformine aurait un effet neuro protecteur dans les pathologies neurodégénératives. Les effets bénéfiques de la metformine s’apparentent à ceux observés au cours de la restriction calorique, lesquels concourent à prolonger l’espérance de vie. Ainsi, la metformine peut être considérée comme un mimétique de la restriction calorique qui pourrait avoir des propriétés antivieillissement.
Place de la Metformine dans la prise en charge de l’infertilité
La metformine a trouvé une place bien légitime dans la prise en charge de certaines patientes infertiles du fait de son effet sur l’insulino-résistance. Celle-ci est communément observée chez les patientes en simple surpoids ou obèses mais également chez les femmes présentant les caractéristiques cliniques / biologiques du Syndrome des Ovaires polykystiques (SOPK), quel que soit leur IMC. Dans ces 2 situations, l’insulino-résistance induit une hypersécrétion d’insuline dont les effets hépatiques, ovariens, surrénaliens et hypophysaires conduisent à un excès de la production d’androgènes comme indiqué dans le schéma ci-dessous (Figure 3). De ce fait, il faut considérer que l’insuline agit comme une véritable co-gonadotrophine (principalement LH-like) et que toute situation d’hyper insulinémie expose à un risque potentiel d’hyper réponse ovarienne. En effet, la stimulation de la 17 alpha hydroxylase ovarienne par l’insuline s’explique par le fait que, à l’inverse des tissus périphériques, l’insulino-résistance est absente au niveau de la thèque interne qui reste extrêmement sensible à l’insuline. L’hyper-androgénie intra-ovarienne qui en résulte contribue à l’anovulation chronique (19). C’est donc dans le cadre de cette hyper-androgénie que la Metformine a trouvé de nouvelles indications chez l’adolescente (acné, séborrhée, hirsutisme) ou chez la femme infertile (troubles de l’ovulation, risques d’hyperstimulation).
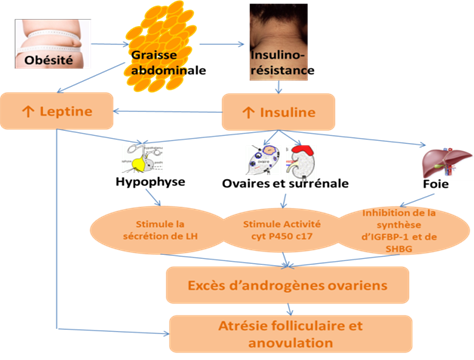
Figure 3 : Relations entre obésité, hyper insulinémie, hyper androgénie et anovulation..
Effets de la Metformine sur l’hyper androgénie clinique
Compte tenu du lien établi entre la sécrétion d’insuline et celle des androgènes, il a été proposé de traiter l’acné, la séborrhée mais surtout l’hirsutisme modéré par la Metformine surtout en cas de surpoids associé. Selon une méta-analyse récente de 46 études (20), la Metformine ne présente pas une efficacité comparable à celle d’une contraception orale par oestro-progestatifs. Elle peut, néanmoins, être associée à celle-ci en cas de surpoids et de syndrome métabolique.
Néanmoins, l’administration de Metformine pendant 24 mois permet une régularisation des cycles menstruels, effet d’autant plus marqué que la patiente présente un taux de testostérone élevé sans surpoids ou, inversement, un surpoids avec un taux de testostérone normal (21).
Effets de la metformine dans l’anovulation chronique
La publication récente des recommandations de la Société Américaine de Fertilité (22) et la mise à jour des méta-analyses antérieures (23) apportent quelques précisions quant à la place de la Metformine dans le panel des inducteurs de l’ovulation. Voici ces données pour l’ensemble de la population de SOPK étudiée :
- La Metformine est plus efficace qu’un placebo (ou l’absence de traitement) pour améliorer les taux d’ovulation et de naissance.
- La Metformine est moins efficace que le citrate de clomiphène (CC) en ce qui concerne le taux d’ovulation mais pas de différence en termes de taux de naissance.
- L’association Metformine + CC parait plus efficace que le CC seul pour obtenir une ovulation chez les patients dites « résistantes au CC » mais un effet sur les taux de naissance reste incertain.
- Les données évaluant l’intérêt de la Metformine en association avec le Letrozole ou le drilling ovarien sont insuffisantes pour permettre une conclusion.
- Un certain consensus existe pour dire que le taux de fausses couches n’est, en général, pas influencé par la prise de Metformine.
- L’association de la Metformine aux gonadotrophines améliore significativement les taux de grossesse clinique et de naissance (24)
Ces données sont un peu frustrantes car l’impact du surpoids (et donc de l’insulino-résistance) est, en général, difficile à évaluer. En effet, l’hétérogénéité des populations étudiées rend hasardeuses les conclusions des méta-analyses. Cette hétérogénéité concerne aussi bien le mode d’évaluation de l’insulino-résistance que la définition des patientes qualifiées de SOPK et dont les phénotypes sont extrêmement variés. Rappelons, à cette occasion, la place de la mesure de la Sex Hormone Binding protéine (SHBG), simple et peu onéreuse, dont la production hépatique est réduite par l’insuline. Faut-il réserver la Metformine aux seules patientes dont le taux de SHBG sérique est réduit ?
Par ailleurs, il existe probablement une prédisposition génétique (44% des patientes seraient réfractaires à la Metformine) du fait d’un polymorphisme du gène STK11 qui code pour une Kinase impliquée dans l’insulino-résistance (25). Il reste donc de nombreuses inconnues !
Place de la Metformine dans les protocoles de FIV-ICSI
Une méta-analyse récente fait le point sur l’intérêt de l’administration de Metformine avant et pendant une tentative de FIV-ICSI (26). La dose quotidienne de Metformine variait de 1.000 à 1.700 mg et pour des durées variables (16 semaines avant la stimulation – Jour 1 de la stimulation) et était poursuivie pendant toute la tentative elle-même. (26). A partir de l’analyse de 13 études prospectives (1.123 patientes), les auteurs arrivent aux conclusions suivantes :
- Les patientes traitées par Metformine dans le cadre d’un protocole long GnRH agoniste (8 études) ont présenté une amélioration non significative des taux de naissance alors qu’une augmentation significative des taux de grossesse a été observée.
- L’utilisation d’un protocole GnRH antagoniste associé à la Metformine pourrait conduire à une diminution des taux de naissance, résultat à nuancer car relevant d’une seule étude. Pas d’évidence pour les taux de grossesse.
- Pas de modification de l’incidence des fausses couches.
- La prise de Metformine a été associée à une réduction significative des risques d’hyper stimulation ovarienne (OHSS) (27). Il est clair que, sur ce terrain à risque, cet effet bénéfique de la Metformine est un facteur à prendre en compte en particulier chez les patientes dont l’IMC était supérieur à 26 (27) même si aucune corrélation avec une amélioration de l’hyper androgénie ou de l’insulino-résistance n’a pu être observée.
Place de la Metformine dans la prise en charge des troubles métaboliques de de la grossesse.
Cette question concerne en premier lieu les patientes atteintes de SOPK qui ont un risque accru d’intolérance glucidique et de diabète de type II d’autant plus élevé que les patientes sont en surpoids. Néanmoins, l’incidence du trouble métabolique diffère selon l’ethnie. En effet, l’intolérance glucidique est 5 fois supérieure en Asie, 4 fois aux USA et 3 fois en Europe. Le diabète avéré de type 2 a une incidence 4 à 5 fois supérieure en Asie et USA, mais identique en Europe (28). Cette prédisposition des patientes SOPK aux troubles métaboliques explique l’incidence accrue de diabète gestationnel mais également un véritable risque obstétrical : hypertension artérielle, pré-éclampsie, modifications du poids de naissance (29-30). Quelle peut être la place de la Metformine en cas de grossesse chez les patientes SOPK ? Elle demeure encore discutée car l’analyse des seules études randomisées indique que l’administration de metformine ne modifie pas significativement le risque de développer un diabète (31).
Néanmoins, cette question de l’intérêt de la prescription de Metformine au cours de la grossesse concerne toutes les patientes enceintes qu’elles présentent ou non un SOPK. Compte tenu que la Metformine traverse le placenta, il était indispensable d’évaluer le ratio bénéfice-risque de cette prescription.
Les recommandations actuelles reposent sur les effets bénéfiques attendus selon l’existence ou non d’un diabète durant la grossesse.
- En cas de diabète gestationnel avéré, la metformine permet, en comparaison à l’insuline, une réduction de la prise de poids chez les femmes en surpoids ou obèses, et de la graisse viscérale chez l’enfant ainsi qu’une meilleure compliance au traitement (32)
- Chez les femmes enceintes obèses (IMC > 30 ou 35) mais non diabétiques, l’administration de Metformine ne modifierait pas le poids de naissance des enfants mais réduirait, chez la mère, la prise de poids et le risque de pré-éclampsie (33-34).
Les conséquences anthropométriques de la prescription de Metformine ont été également évaluées :
- A 32 semaines d’aménorrhée, la circonférence de la tête était plus grande uniquement chez les fœtus des femmes en surpoids ou obèses alors que leur taille était significativement réduite quand les patientes avaient un poids normal (35).
- A l’âge de 4 ans, 2 études prospectives randomisées ont évalué les conséquences de la prise de Metformine pendant la grossesse (36) : aucun effet sur la circonférence de la tête ou la taille mais poids significativement augmenté (IMC 16.6 vs 15.9 p<0.005).
Enfin, existe-t-il un risque accru de malformations majeures ? Chez les patientes traitées durant le 1er trimestre de gestation, aucune augmentation des taux de malformations n’a pu être observée (37). `
Si ces données sont plutôt rassurantes, elles nécessitent néanmoins d’être confirmées par des études complémentaires. De ce fait, il semble raisonnable d’envisager l’utilisation de la Metformine uniquement durant le 1er trimestre de gestation chez les patientes présentant un diabète gestationnel, tout en sachant que l’AMM de ce produit n’a pas été accordée dans cette situation (38).
Conclusion
Comme indiqué précédemment, la Metformine peut revendiquer une place légitime pour améliorer la fécondité des patientes, en particulier celles atteintes de SOPK. De plus, ses nombreuses cibles d’action lui permettent de trouver des indications qui dépassent le seul contrôle glycémique et de l’insulino-résistance : pré-éclampsie, pathologies cardio-vasculaires et risques de mortalité, pathologies cancérologiques, effets de l’âge et troubles neurologiques associés. Bien que la littérature soit encore limitée dans certains domaines d’application, le potentiel thérapeutique de la Metformine pourrait nous surprendre comme l’évoque l’article de Roméro et al. (39)
Bibliographie
1.Nathan D et al. Medical management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes.
Diabetes Care 2009; 32:193.
2. Holman R. Metformin as first choice in oral diabetes treatment: The UKPDS experience.
J Annu Diabet Hotel Dieu 2007:13-20.
3. Palmer SC et al. Comparison of clinical outcomes and adverse events associated with glucose- lowering drugs in patients with type 2 diabetes: a meta-analysis.
JAMA 2016; 31; 313–24.
4. El-Mir MY et al. Dimethylbiguanide Inhibits Cell Respiration via an Indirect Effect Targeted on the Respiratory Chain Complex I*
J Biol Chem 2000; 275 :223-8.
5. Foretz M et al. Understanding the glucoregulatory mechanisms of metformin in type 2diabetes mellitus.
Nature RevIews | Endocrinology 2019: 15: 569-89.
6. Natali A et al. Metformin is the key factor in elevated plasma growth differentiation factor-15 levels in type 2 diabetes: a nested, case–control study.
Diabetes Obes. Metab. 2018 ;412-6.
7. Coll AP et al. GDF15 mediates the effects of metformin on body weight and energy balance
Nature. 2020. 578: 444-8.
8. Shu Y et al. Effect of genetic variation in the organic cation transporter 1 (OCT1) on metformin action. J Clin Invest 2007 ;117: 1422-31
9. Domecq JP et al. Drugs commonly associated with weight change: a systematic review and meta-analysis.
J Clin Endocrinol Metab 2015 ;100 :363–70
10. Diabetes Prevention Program Research Group. Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year follow-up: The Diabetes Prevention Program Outcomes Study.
Lancet Diabetes Endocrinol 2015 ;11 :866–75.
11. Holman RR et al. 10-year follow-up of intensive glucose control in type 2 diabetes.
N Engl J Med 2008 ;359 :1577–89.
12. Zilov AV et al. Mechanisms of action of metformin with special reference to cardiovascular protection.
Diabetes Metab Res Rev. 2019 ;25 e 3173.l
13. Evans JM et al. Metformin and reduced risk of cancer in diabetic patients.
Br. Med. J. 2005 ;330,1304-5.
14. Bodmer et al. (Long-term metformin use is associated with decreased risk of breast cancer.
Diabetes Care 2010 ;33,1304-8.
15. Viollet B, Foretz M. Revisiting the mechanisms of metformin action in the liver
Ann. Endocrinol. 2013; 74: 123-29.
16. Kulkarni AS et al. Metformin regulates metabolic and nonmetabolic pathways in skeletal muscle and subcutaneous adipose tissues of older adults.
Aging Cell 2018 ;17 e12723.
17. Cheng C et al. Type 2 diabetes and antidiabetic medications in relation to dementia diagnosis. J Gerontol A Biol Sci Med Sci 2014 ;69 :1299–305.
18. Foretz M, Viollet B. Les nouvelles promesses de la Metformine : vers une meilleure compréhension de ses mécanismes d’action.
Médecine / Sciences 2014;30 :82-92
19. Burghen GA et al.
Correlation of hyperandrogenism with hyperinsulinism in polycystic ovarian disease.
J Clin Endocrinol Metab 1980 ;50 :113-6.
20. Teede H et al. Effect of combined oral contraceptive pill and/or metformin in the management of polycystic ovary syndrome: a systematic review with meta-analyses.
Clin Endocrinol 2019 ;91: 479-89.
21.Yang PK et al. The efficacy of 24-Month Metformin for Improving Menses, Hormones, and Metabolic Profiles in Polycystic Ovary Syndrome
J Clin Endocrinol Metab 2018; 03 :890-9
22. Practice Committee of the American Society for Reproductive Medicine
Role of metformin for ovulation induction in infertile patients with polycystic ovary syndrome (PCOS):
a guideline
Fertll Steril 2017;108: 426-41.
23. Sharpe A et al. Metformin for ovulation induction (excluding gonadotrophins) in women with polycystic ovary syndrome (Review)
Cochrane Database of Systematic Reviews 2019.
24. Bordewijk EM al. Metformin during ovulation induction with gonadotrophins followed by timed intercourse or intrauterine insemination for subfertility associated with polycystic ovary syndrome
Cochrane Database of Systematic Reviews 2017.
25. Legro R et al. Ovulatory response to treatment of polycystic Ovary Syndrome is associated with a polymorphism in the STK11 Gene.
J Clin Endocrinol Metab 2008; 93 :792-800.
26. Tso LO et al.
Metformin treatment before and during IVF or ICSI in women with polycystic ovary syndrome.
Cochrane Database of systematic review 2020.
27. Wu Y et al. Association of Metformin with Pregnancy Outcomes in Women with Polycystic Ovarian Syndrome Undergoing In Vitro Fertilization A Systematic Review and Meta-analysis
JAMA Netw Open. 2020; 3: e2011995.
28. Kakoly NS et al. Ethnicity, obesity and the prevalence of impaired glucose tolerance and type 2 diabetes in PCOS: a systematic review and meta-regression.
Hum Reprod Update 2018 ;24 :445-67.
29. Palomba S et al. Pregnancy complications in women with polycystic ovary syndrome
Hum Reprod Update 2015 ;221 :575-92.
30. ShaT et al. A meta-analysis of pregnancy-related outcomes and complications in women with polycystic ovary syndrome undergoing IVF.
Reprod BioMed Online 2019 ;39 :281-93.
31. Zhuo Z et al. Effect of Metformin Intervention during Pregnancy on the Gestational Diabetes Mellitus in Women with Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis
Journal of Diabetes Research. 2014.
32. Balsells M et al. Glibenclamide, metformin, and insulin for the treatment of gestational diabetes: a systematic review and meta-analysis
British Med J. 2015; 350: h102.
33. Chiswick C et al. Effect of metformin on maternal and fetal outcomes in obese pregnant women (EMPOWaR): a randomised, double-blind, placebo-controlled trial
Lancet Diabetes Endocrinol. 2015; 3: 778–86.
34. Syngelaki A et al. Metformin versus Placebo in Obese Pregnant Women without DiabetesMellitus
N Engl J Med 2016; 374 :434-3.
35. Hjorth-Hansen A et al. Fetal Growth and Birth Anthropometrics in Metformin-Exposed Offspring Born to Mothers With PCOS
J Clin Endocrinol Metab 2018; 103 :740-7.
36. Hanem LGE et al. Metformin Use in PCOS Pregnancies Increases the Risk of Offspring Overweight at 4 Years of Age: Follow-Up of Two RCTs
J Clin Endocrinol Metab 2019; 103: 1612-21.
37. Cassina M et al. First-trimester exposure to metformin and risk of birth defects: a systematic review and meta-analysis
Hum Reprod Update 2014; 20 :656–69.
______ ______
38. Gonzalez CD et al. Metformin and Pregnancy Outcomes: Evidence Gaps and Unanswered Questions
Current Clinical Pharmacology, 2019, 14, 54-60
39. Romero R et al.
Metformin, the aspirin of the 21st century: its role in gestational diabetes mellitus, prevention of
preeclampsia and cancer, and the promotion of longevity
Am J Obst & Gyn 2017; :282-302



