Clémentine GONTHIER, Hélène COURCIER, Margot BUCAU, Theresa ISRAEL, Sébastien CLEMENT DE GIVRY, Martin KOSKAS
Dans environ 5 % des cas, le cancer de l’endomètre (CE) touche des femmes en âge de procréer [1]–[3]. Outre des troubles du cycle, les lésions endométriales de la femme jeune sont souvent diagnostiquées lors d’un bilan d’infertilité [1], [4], [5]. L’hyper-œstrogènie, une dysovulation et le syndrome des ovaires polykystiques favorisent l’apparition d’hyperplasies voire de néoplasies endométriales. Le désir de grossesse étant devenu plus tardif qu'avant, la fréquence de ces pathologies augmente chez les femmes ayant un projet de grossesse. Dans ces cas, l’hystérectomie demeure le traitement de référence, quel que soit l’âge de survenue. Un traitement médical avec conservation de l’utérus est envisageable dans certains cas après un bilan pré-thérapeutique rigoureux. Il a pour objectif la rémission complète des lésions endométriales pour l’obtention d’une (ou plusieurs) grossesse(s).
Depuis plus de cinquante ans, la littérature confirme la sécurité d’une prise en charge conservatrice mais le niveau de preuve demeure faible pour la production de recommandations concernant ses modalités [6], [7]. Ainsi, il est préconisé d’adresser ces patientes à un centre spécialisé.
Pour guider les médecins et les patientes, le centre PREFERE (PREservation de la FERtilité et cancer de l’Endomètre http://hupnvs.aphp.fr/centre-prefere) de l’hôpital Bichat Claude-Bernard à Paris a vocation à rendre un avis éclairé et permettre une relecture des prélèvements histologiques. En effet avant d’envisager un traitement conservateur il est recommandé de confirmer le diagnostic par un pathologiste expérimenté en pathologie gynécologique [7]. Le centre PREFERE ambitionne également de colliger à l’échelle nationale les cas déclarés (déclaration CNIL numéro 1919700 v 0).
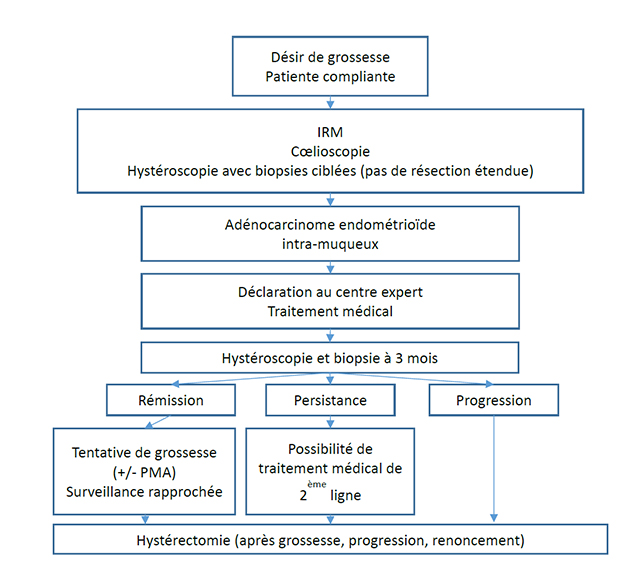
Le bilan pré-thérapeutique comporte une IRM (pelvienne et lombo-aortique) ainsi qu’une cœlioscopie exploratrice associée à une hystéroscopie permettant de guider les prélèvements afin d’améliorer la sensibilité du diagnostic histologique (les biopsies hystéroscopiques étant plus performantes que la dilatation associée au curetage ou la pipelle [8],[9], [10]).
A l’issue de ce bilan le traitement conservateur est réservé aux CE de type I, c’est à dire les carcinomes de type endométrioïde hormonodépendant, ayant l’hyperplasie atypique comme lésion précurseur [11], de stade IA sans envahissement du myomètre, chez une femme désireuse de grossesse, et compliante.
Classiquement le traitement conservateur est réservé aux carcinomes endométrioïdes de grade 1 en opposition aux carcinomes endométrioïdes de grade 2 et 3 de moins bon pronostic. La plus importante série de traitement conservateur pour des grades 2 et 3 compte seulement 13 cas [12]. Quatorze autres cas ont été décrits dans la littérature [13]–[17]. Les résultats de ces études sont encourageants mais les suivis très courts. Si un traitement conservateur pour un carcinome endométrioïde de grade 2 ou 3 est envisagé il doit être prudent, limité dans le temps et géré par des oncologues gynécologues expérimentés utilisant des protocoles bien définis avec un suivi rapproché.
Depuis peu la classification moléculaire des cancers de l’endomètre (mise à jour par l’OMS en 2020 [18]), permet d’identifier 4 principaux groupes histo-moléculaires : le groupe « microsatellites instables » (MSI), le groupe « ultra-muté » (mutation POLE), le groupe à « faible nombre de copies » (mutations PTEN, ARID1A…) et le groupe « chromosomes instables » (mutation p53). Ces groupes ont une valeur pronostique majeure, leur prise en compte est désormais nécessaire dans les indications des traitements conservateurs des CE [19].
Il n’existe pas de recommandation sur un schéma type de traitement médical. Les traitements les plus étudiés son l’acétate de megestrol (MA), l’acétate de medroxyprogestérone (MPA), le stérilet au levonorgestrel (DIU-LNG) et les analogues de la LHRH, sans consensus sur leur mode d’administration [20]. Dans une méta analyse de 2014 incluant 370 patientes seul le MA était associé à une augmentation du taux de rémission (OR 2,7 IC 95% 1,2-6,0) et une diminution du risque de progression [21] ce qui n’a pas été retrouvé dans l’actualisation de 2019 [20]. La prise de poids liée au MA n’est pas négligeable et notamment plus importante qu’avec le DIU-LNG (2,95 kg versus 0,05 kg p=0,03) [22], alors que l’obésité réduit les chances de grossesse [23].
L'utilisation de la metformine semble associée à une amélioration de survie globale des patientes atteintes d'un CE et à une diminution du risque de récidive [24], particulièrement en cas de diabète. Il est important de noter que la résection hystéroscopique étendues des lésions endométriales visibles n’est pas recommandée du fait du risque de complication pour la fertilité et la grossesse.
Le protocole du registre national propose un traitement de première intention par Acétate de Chlormadinone, 10mg par jour pendant 3 mois [25]. Ce choix est basé sur la bonne tolérance de ce traitement, la limitation des effets indésirables et la sécurité de son usage chez les patientes à risque, pour des durées de traitement courtes [26], [27].
A l’issue du traitement la réponse est évaluée par hystéroscopie et biopsie de l’endomètre à 3 mois. Le taux de rémission complète est de 75% après traitement médical, toutes molécules confondues [20].
En cas de rémission une grossesse est autorisée avec possibilité de prise en charge en Procréation Médicalement Assistée classique [28], [29]. Dans deux méta-analyses, un tiers des femmes obtenaient au moins une grossesse [21], [30].
En cas de persistances des lésions un traitement de 2ème ligne peut être envisagé.
Devant des probabilités estimées de récidive à 29% à 24 mois et de progression de 15% [21], une surveillance rapprochée semble incontournable. Le registre national propose une surveillance tous les 3-4 mois par hystéroscopie et biopsie de l’endomètre [25]. L’ESGO propose une surveillance tous les 6 mois par échographie pelvienne et examen clinique avec réalisation de biopsies hystéroscopiques en cas de saignement utérin anormal ou de résultats échographiques atypiques [7].
En cas de progression ou persistance après un traitement de 2ème ligne, il faut savoir renoncer au traitement conservateur. Les recommandations européennes préconisent un traitement chirurgical standard si aucune réponse n'est obtenue après 6 mois [7].
Aux vues des connaissances actuelles, du fait du risque de récidive, le traitement par hystérectomie totale constitue la dernière étape du traitement conservateur. Elle doit être envisagée après accomplissement du projet parental, après renoncement et doit être discuté en cas de récidive. L’information des patientes en début et tout au long de la prise en charge est capitale.
[1] I. Navarria et al., « Young patients with endometrial cancer: how many could be eligible for fertility-sparing treatment? », Gynecol. Oncol., vol. 114, no 3, p. 448‑451, sept. 2009, doi: 10.1016/j.ygyno.2009.05.038.
[2] K. Y. Lin et al., « Ovarian involvement in endometrioid adenocarcinoma of uterus », Gynecol. Oncol., vol. 138, no 3, p. 532‑535, sept. 2015, doi: 10.1016/j.ygyno.2015.07.012.
[3] S. D. Reed et al., « Complex hyperplasia with and without atypia: clinical outcomes and implications of progestin therapy », Obstet. Gynecol., vol. 116, no 2 Pt 1, p. 365‑373, août 2010, doi: 10.1097/AOG.0b013e3181e93330.
[4] T. C. Randall et R. J. Kurman, « Progestin treatment of atypical hyperplasia and well-differentiated carcinoma of the endometrium in women under age 40 », Obstet. Gynecol., vol. 90, no 3, p. 434‑440, sept. 1997, doi: 10.1016/s0029-7844(97)00297-4.
[5] G. Gitsch, E. Hanzal, D. Jensen, et N. F. Hacker, « Endometrial cancer in premenopausal women 45 years and younger », Obstet. Gynecol., vol. 85, no 4, p. 504‑508, avr. 1995, doi: 10.1016/0029-7844(95)00001-8.
[6] A. Rodolakis et al., « European Society of Gynecological Oncology Task Force for Fertility Preservation: Clinical Recommendations for Fertility-Sparing Management in Young Endometrial Cancer Patients », Int. J. Gynecol. Cancer Off. J. Int. Gynecol. Cancer Soc., vol. 25, no 7, p. 1258‑1265, sept. 2015, doi: 10.1097/IGC.0000000000000493.
[7] N. Concin et al., « ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma », Int. J. Gynecol. Cancer Off. J. Int. Gynecol. Cancer Soc., vol. 31, no 1, p. 12‑39, janv. 2021, doi: 10.1136/ijgc-2020-002230.
[8] N. C. M. Visser, C. Reijnen, L. F. A. G. Massuger, I. D. Nagtegaal, J. Bulten, et J. M. A. Pijnenborg, « Accuracy of Endometrial Sampling in Endometrial Carcinoma: A Systematic Review and Meta-analysis », Obstet. Gynecol., vol. 130, no 4, p. 803‑813, 2017, doi: 10.1097/AOG.0000000000002261.
[9] A. Di Spiezio Sardo et al., « Should endometrial biopsy under direct hysteroscopic visualization using the grasp technique become the new gold standard for the preoperative evaluation of the patient with endometrial cancer? », Gynecol. Oncol., vol. 158, no 2, p. 347‑353, août 2020, doi: 10.1016/j.ygyno.2020.05.012.
[10] V. Lago, B. Martín, E. Ballesteros, J. M. Cárdenas-Rebollo, et L. Minig, « Tumor Grade Correlation Between Preoperative Biopsy and Final Surgical Specimen in Endometrial Cancer: The Use of Different Diagnostic Methods and Analysis of Associated Factors », Int. J. Gynecol. Cancer Off. J. Int. Gynecol. Cancer Soc., vol. 28, no 7, p. 1258‑1263, sept. 2018, doi: 10.1097/IGC.0000000000001304.
[11] A. A. Suarez, A. S. Felix, et D. E. Cohn, « Bokhman Redux: Endometrial cancer “types” in the 21st century », Gynecol. Oncol., vol. 144, no 2, p. 243‑249, févr. 2017, doi: 10.1016/j.ygyno.2016.12.010.
[12] J.-Y. Park et al., « Hormonal therapy for women with stage IA endometrial cancer of all grades », Obstet. Gynecol., vol. 122, no 1, p. 7‑14, juill. 2013, doi: 10.1097/AOG.0b013e3182964ce3.
[13] A. J. Brown, S. N. Westin, R. R. Broaddus, et K. Schmeler, « Progestin intrauterine device in an adolescent with grade 2 endometrial cancer », Obstet. Gynecol., vol. 119, no 2 Pt 2, p. 423‑426, févr. 2012, doi: 10.1097/AOG.0b013e318234d97c.
[14] W. H. Gotlieb et al., « Outcome of fertility-sparing treatment with progestins in young patients with endometrial cancer », Obstet. Gynecol., vol. 102, no 4, p. 718‑725, oct. 2003.
[15] T. Kaku et al., « Conservative therapy for adenocarcinoma and atypical endometrial hyperplasia of the endometrium in young women: central pathologic review and treatment outcome », Cancer Lett., vol. 167, no 1, p. 39‑48, juin 2001.
[16] M. Koskas et al., « Fertility-sparing management of grade 2 and 3 endometrial adenocarcinomas », Anticancer Res., vol. 31, no 9, p. 3047‑3049, sept. 2011.
[17] J. Sardi, J. P. Anchezar Henry, G. Paniceres, N. Gomez Rueda, et S. Vighi, « Primary hormonal treatment for early endometrial carcinoma », Eur. J. Gynaecol. Oncol., vol. 19, no 6, p. 565‑568, 1998.
[18] World Health Organization, Female genital tumours. 2020.
[19] A. León-Castillo et al., « Molecular Classification of the PORTEC-3 Trial for High-Risk Endometrial Cancer: Impact on Prognosis and Benefit From Adjuvant Therapy », J. Clin. Oncol. Off. J. Am. Soc. Clin. Oncol., vol. 38, no 29, p. 3388‑3397, oct. 2020, doi: 10.1200/JCO.20.00549.
[20] S. Guillon, N. Popescu, J. Phelippeau, et M. Koskas, « A systematic review and meta-analysis of prognostic factors for remission in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma », Int. J. Gynaecol. Obstet. Off. Organ Int. Fed. Gynaecol. Obstet., vol. 146, no 3, p. 277‑288, sept. 2019, doi: 10.1002/ijgo.12882.
[21] M. Koskas, J. Uzan, D. Luton, R. Rouzier, et E. Daraï, « Prognostic factors of oncologic and reproductive outcomes in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma: systematic review and meta-analysis », Fertil. Steril., vol. 101, no 3, p. 785‑794, mars 2014, doi: 10.1016/j.fertnstert.2013.11.028.
[22] D. Cholakian, K. Hacker, A. N. Fader, P. A. Gehrig, et E. J. Tanner, « Effect of oral versus intrauterine progestins on weight in women undergoing fertility preserving therapy for complex atypical hyperplasia or endometrial cancer », Gynecol. Oncol., vol. 140, no 2, p. 234‑238, févr. 2016, doi: 10.1016/j.ygyno.2015.12.010.
[23] C. Gonthier, F. Walker, D. Luton, C. Yazbeck, P. Madelenat, et M. Koskas, « Impact of obesity on the results of fertility-sparing management for atypical hyperplasia and grade 1 endometrial cancer », Gynecol. Oncol., vol. 133, no 1, p. 33‑37, avr. 2014, doi: 10.1016/j.ygyno.2013.11.007.
[24] D. Chu et al., « Effect of metformin use on the risk and prognosis of endometrial cancer: a systematic review and meta-analysis », BMC Cancer, vol. 18, no 1, p. 438, avr. 2018, doi: 10.1186/s12885-018-4334-5.
[25] C. Gonthier, A. Trefoux-Bourdet, D. Luton, et M. Koskas, « [Fertility-sparing management of endometrial cancer and atypical hyperplasia] », Gynecol. Obstet. Fertil. Senol., vol. 45, no 2, p. 112‑118, févr. 2017, doi: 10.1016/j.gofs.2016.12.011.
[26] N. Chabbert-Buffet et al., « Pregnane progestin contraception in systemic lupus erythematosus: a longitudinal study of 187 patients », Contraception, vol. 83, no 3, p. 229‑237, mars 2011, doi: 10.1016/j.contraception.2010.08.012.
[27] « Lutényl/Lutéran et génériques : recommandations préliminaires suite à la confirmation du sur-risque de méningiome. Etude du (GIS) EPI-PHARE. ANSM 2021. » .
[28] S. E. Elizur, M. E. Beiner, J. Korach, A. Weiser, G. Ben-Baruch, et J. Dor, « Outcome of in vitro fertilization treatment in infertile women conservatively treated for endometrial adenocarcinoma », Fertil. Steril., vol. 88, no 6, p. 1562‑1567, déc. 2007, doi: 10.1016/j.fertnstert.2007.01.058.
[29] J.-Y. Park et al., « Pregnancy outcomes after fertility-sparing management in young women with early endometrial cancer », Obstet. Gynecol., vol. 121, no 1, p. 136‑142, janv. 2013, doi: 10.1097/aog.0b013e31827a0643.
[30] C. C. Gunderson, A. N. Fader, K. A. Carson, et R. E. Bristow, « Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adenocarcinoma: a systematic review », Gynecol. Oncol., vol. 125, no 2, p. 477‑482, mai 2012, doi: 10.1016/j.ygyno.2012.01.003.



