Il existe différents mal positionnements d’un DIU :
- La perforation complète (la totalité du DIU est extériorisé de l’utérus)
- La perforation partielle (une partie du DIU est extériorisé de l’utérus).
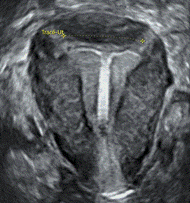
- L’enchâssement (une partie du DIU pénètre le myomètre). (Figure 1)
- La rotation du DIU (horizontale ou verticale). (Figure 2)
- L’insertion basse (Figure 3 et 4)
|
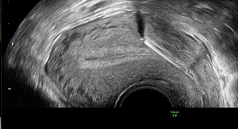
Figure 1 : sur cet utérus rétroversé en coupe sagittale, le corps hyperéchogène du DIU au cuivre est enchâssé au sein du myomètre antérieur sur environ 5 mm. |
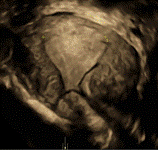
Figure 2 : coupe frontale de l’utérus mettant en évidence un DIU basculé dans la cavité. Le corps du DIU est situé dans une corne tandis que les ailettes sont déployées tête en bas dans la cavité. |
|
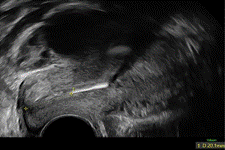
Figure 3 (coupe sagittale) et 4 (coupe frontale) : DIU au cuivre bas situé cervico-isthmique chez une patiente présentant des douleurs pelviennes. |
Les critères échographiques de bon positionnement d’un DIU comprennent (1) :
- Dispositif dans la cavité utérine proche du fond utérin.
- Tige dans l’axe du fond utérin.
- Extrémité inférieure de la tige au-dessus du col.
- DIU (bas ou tige) non enchâssé dans le myomètre.
- Bras du DIU déployés en direction des cornes utérines.
En cas de doute à l’échographie 2D, la 3D (reconstruction frontale) permet d’affiner la position du DIU (Figure 5). L’échographie 3D est notamment supérieure à la 2D pour le diagnostic d’enchâssement myométrial. (NP2) (1)
Dans l’étude par Turok et al., sur 50 DIU diagnostiqués comme enchâssés dans le myomètre, seulement 15 (9,6%) l'étaient réellement au moment du retrait chirurgical (2). Les faux positifs sont ainsi à considérer.
|
|
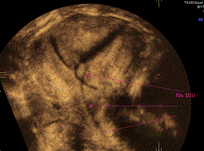
Figure 5 : coupe frontale (coronale) de l’utérus, obtenue par reconstruction en 3D. Le DIU au cuivre (hyperéchogène) est en position corporéo-fundique (bien positionné). |
Il existe plusieurs mesures pour évaluer la position d’un DIU. Cependant, il n’existe pas de seuil échographique de distance entre le DIU et le fond utérin, l’endomètre ou le myomètre pour affirmer le bon positionnement du dispositif.
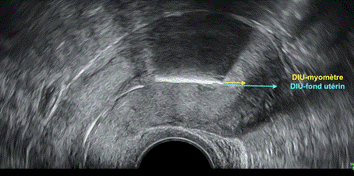
Si une telle mesure est effectuée, la distance DIU-myomètre (seuil à 11 mm) semble plus pertinente que la distance DIU-fond utérin (seuil à 27 mm) car elle ne dépend pas de l’épaisseur du myomètre (accord professionnel). (Figure 6)
|
|
Figure 6 : coupe sagittale de l’utérus. |
Fréquence
Une étude portant sur plus de 17 000 insertions a montré un taux de 1,6 perforations utérines pour 1000 insertions (comprenant les enchâssements et les perforations partielles et totales). (3)
Ce taux varie entre 0,1 et 3 pour 1000 dans la littérature. (4)
A noter que cette donnée est probablement sous-estimée par la non-détection des formes asymptomatiques.
Délais de survenue
Certaines études montrent que la perforation à lieu le plus souvent au moment de l’insertion (85% des cas) et est le plus souvent asymptomatique (86% de non-détection après la pose du DIU et 46% de non détection durant l’année qui suit la pose). (3)(4)
Plus rarement (15% des cas), elle survient ultérieurement (une hypothèse est la perforation partielle du myomètre au moment de la pose). Les contractions utérines pourraient entraîner secondairement le DIU à l’extérieur de l’utérus.
Facteur de risques
Le risque de perforation est indépendant de l’âge de la patiente. (1)(5)
Les facteurs de risque communément admis sont : l’allaitement en cours, un délai inférieur 6 mois par rapport à l'accouchement, et une version (anté ou rétro) utérine extrême (NP2). (1),(4),(6),(7)
D’après l’étude EURAS (incluant 60 595 patientes) recherchant comme facteur de risque le post-partum, l’allaitement, les antécédents médicaux et gynécologiques, 34 perforations sur 49 étaient associées à un risque. (14)
Certains auteurs indiquent que le post-partum est un facteur de risque de malposition extra-utérine du DIU (et non intra-utérine). (9)
Selon Maria W et al., 90 % des perforations utérines surviendraient chez des patientes dont le DIU a été posé dans la première année du post-partum, dont 50 à 60 % les trois premiers mois. (10)
Cependant compte-tenu du très faible risque de perforation, la pose du DIU n’est pas contre-indiquée dans le post-partum chez une femme allaitante. L’OMS recommande d’attendre 4 semaines après un accouchement avant de mettre en place un DIU. (11)
La pose d’un DIU au cuivre dans les 48 heures après un accouchement est possible (donnée de la HAS mise à jour en 2019), mais n’est pas d’usage courant en France.(12)
Les données concernant l’expérience de l’opérateur sont assez hétérogènes.
L’étude C.Boyon portant sur 11 cas de perforations, ne montrait pas d’influence de l’expérience de l’opérateur sur ce risque. (13)
Dans une cohorte prospective observationnelle ayant inclus 17 000 poses de DIU au cuivre dont 28 perforations, il existait un risque significativement augmenté de perforations chez les praticiens réalisant moins de 10 poses de DIU par an (3 pour 1000) par rapport à ceux effectuant 50 à 99 poses par an (0,4 pour 1000) (NP2). Cependant à contrario, le taux de perforations était supérieur chez les praticiens réalisant plus de 100 poses par an (1,7 pour 1000) que ceux réalisant 50 à 99 poses par an sans que cela soit significatif. (3)
Certaines études ont retrouvé un taux de perforation plus important avec le DIU au lévonorgestrel qu’avec celui au cuivre. (2) Le CNGOF fait état en 2014 d’une absence de preuve de sur-risque de perforation du DIU au lévonorgestrel par rapport au cuivre et inversement. (13)
Dans la commission de la transparence émise par la HAS en 2017 portant sur 61 448 femmes, 43 078 étaient utilisatrices d’un MIRENA (70,1%) et 18 370 d’un stérilet au cuivre (29,9%).
Un total de 81 perforations utérines a été signalé : 61 avec MIRENA et 20 avec les DIU au cuivre. Le risque relatif brut de perforations utérines avec MIRENA par rapport aux DIU au cuivre a été calculé à 1,30 (IC95% [0,78 ; 2,16]). (21)
Dans l’étude EURAS (incluant 60 595 patientes) ce risque relatif à été calculé à 1,7 (ORadj 1.7; 95% CI: 1.0-2.8). (14)
Norman D Goldstuck et al., ont évalué l’impact de la force du muscle utérin et de l’opérateur sur l'enchâssement et la perforation, à partir d’échantillons d’hystérectomie. (15)
Ils ont observés que les forces d’insertion du DIU varient de 1,5 à 6,5 N, et les forces de perforations de 20 à 54 N. Leurs calculs montrent que l’utérus est capable de générer jusqu’à 50 N de force myométriale.
Ils concluent qu’une perforation primaire peut se produire si la force d’insertion dépasse la résistance à la perforation du fond de l’utérus, notamment si le passage du col est difficile, et la procédure complexe.
Selon les auteurs, le muscle utérin semble capable de générer suffisamment de force pour provoquer une perforation du myomètre, notamment s’il est posé en oblique.
L'enchâssement, la perforation et l’expulsion secondaire du DIU peuvent être favorisés par un déséquilibre entre la taille du DIU et la cavité utérine, entraînant la production de forces asymétriques. (15)
A partir de ces données, le CNGOF évoque en 2014 la possibilité qu’une anomalie dans la répartition des fibres musculaires de l’utérus, chez certaines patientes, soit responsable de la migration secondaire des DIU (4).
Diagnostic clinique de mal position d’un DIU :
L’étude de C. Boyon montre que les douleurs pelviennes (modérées ou violentes) surviennent dans près d’un tiers des cas de perforation (36%). (13)
Celles-ci peuvent toutefois s’observer de façon physiologique en réponse à la présence du dispositif (sans que celui-ci soit mal positionné). Dans une étude de cohorte prospective, les douleurs pelviennes étaient à l’origine des demandes de retrait avant 6 mois d'utilisation dans environ un tiers des cas (NP2). (1)(16)
La non-visualisation des fils au spéculum, la survenue d’une grossesse, ou encore l’impossibilité de le retirer sont d’autres signes d’appel. (13)
Toutefois il existe des formes asymptomatiques de perforations (près de 20% dans l’étude de C. Boyon) dont la proportion n’est pas négligeable. (13)
Les métrorragies persistantes ou associées à des douleurs pelviennes doivent motiver des explorations complémentaires à la recherche d’une complication (AP). (1)
Syndrome occlusif, péritonite, pollakiurie, dysurie, douleur abdominale, diarrhée peuvent traduire la perforation d’un organe creux (vessie, tube digestif). (4)
Les douleurs abdominales, diarrhées, fièvre ou infections urinaires peuvent être le signe d'une perforation intestinale. (17)
Place de l’échographie dans la mise en place et la surveillance des DIU :
- Pré-pose : L’échographie pelvienne n’est pas recommandée avant la pose d’un DIU. Seuls le toucher vaginal avec examen bimanuel et l’inspection cervicale sont recommandés avant la pose d’un DIU. (Grade B) (1)
- Post-pose : certains auteurs préconisent un contrôle échographique après la pose d’un DIU. (17)
Cependant cette pratique n’est pas recommandée en systématique si la patiente est asymptomatique (Grade B), que l’insertion du dispositif s’est déroulée sans difficulté et qu’à l’examen les fils sont vus et de longueur attendue. (NP2) (1)
Il est conseillé de proposer une visite de contrôle dans les semaines qui suivent la pose du DIU pour s’assurer entre autres de la visualisation des fils (accord professionnel). Les femmes doivent également être informées des symptômes devant les amener à consulter (accord professionnel). (1) - Devant une suspicion de stérilet ectopique : l’échographie pelvienne est l’examen de première intention. Un DIU extra-utérin est rarement visualisé à l’échographie sauf s’il est accolé à l’utérus. Ainsi en cas non-visualisation l’ASP est proposé systématiquement dans un second temps, avant de conclure à une expulsion méconnue, mais cet examen ne permet pas de localiser précisément le DIU (particulièrement si celui-ci se projette au niveau du pelvis). (4)
L'IRM ou le scanner permettent une localisation plus précise, et sont souvent utiles avant d’envisager une chirurgie d’exploration du DIU. (4)(17)
Prise en charge des DIU mal placés :
- DIU bas situés : en pratique un DIU en position intra-cervicale doit être retiré et une contraception efficace immédiatement introduite (accord professionnel). (1)
L’attitude est moins univoque en cas de DIU bas situé dans la cavité. Une expectative voire une tentative de repositionnement peuvent être proposées avec une surveillance à 3 mois (NP3). Si passé ce délai le DIU est toujours bas situé, il semble préférable de le retirer chez une patiente symptomatique avec institution d’une contraception efficace (NP3). Chez les personnes asymptomatiques, aucune donnée ne permet de déterminer la supériorité d’une attitude par rapport à l’autre (retirer le DIU ou le laisser en place) en sachant que le risque de grossesse est plus important en cas de retrait du DIU. (NP3) (1)
Environ 10% des DIU seraient situés en position isthmique ou endocervicale, mais tous ne nécessitent pas obligatoirement un retrait. (4) (9) (figure 7)
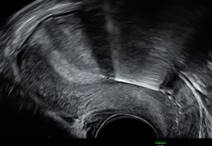
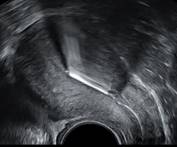
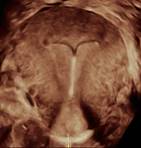
Figure 7 : DIU en position isthmique juste après la pose (patiente asymptomatique).
Six jours plus tard chez la même patiente : DIU remonté en position corporéo-fundique, ailettes déployées en regard des cornes utérines. - Enchâssement d’une partie du DIU dans le myomètre :
Une traction douce sur les fils peut suffire à le retirer en consultation si ces derniers sont visibles. (14) En présence d’une résistance, il est préférable de procéder à l’ablation du DIU sous contrôle hystéroscopique. (4)
Dans la série rétrospective de Turok et al.,le recours à l’hystéroscopie a été nécessaire dans 38 % des cas de retraits difficiles (60 sur 157). A noter que 9,6 % des dispositifs étaient enchâssés dans le myomètre et que leur retrait s’est réalisé le plus souvent sans difficulté. (2)
Ces patientes peuvent ainsi bénéficier d’une prise en charge spécifique. - Perforations utérines :
Dans l’étude de C.Boyon, 64% des perforations étaient prises en charge par coelioscopie seule, et 27% par laparotomie. (13)
Dans la revue de la littérature menée par Gill et al., la laparotomie était utilisée dans 34,6% des cas. (18)
La colonoscopie peut parfois être utile pour extraire un DIU intraluminal (4).La plupart des auteurs s’accordent sur le fait que l’ablation d’un DIU ectopique est nécessaire pour pallier aux risques de complications.
Conséquences des perforations utérines
Environ 15% des perforations utérines entraînent des lésions d’organe de voisinage (érosion de la vessie, du grêle, du côlon, du rectum, de l’appendice par exemple). Les localisations les plus fréquentes sont l’épiploon, le cul de sac vaginal postérieur et le ligament large. (13)(17)
Les localisations de types : mésentères, côlon et vessie sont moins fréquentes. (17) Une cinquantaine de cas de migration intra vésicale de DIU a été rapportée dans la littérature dont la moitié se sont compliqués par la formation d’une lithiase vésicale (4).
La fistule recto-utérine et le rétrécissement du rectum ont également été signalés, ainsi que l’atteinte du mésentère avec possibilité d’infarctus. (19)
Des abcès pelviens ont été décrits, ainsi que des fistules vésico-vaginales. (20)
Un DIU ectopique peut entraîner la formation d’adhérences épiploïques ou pelviennes, parfois responsables d’infertilité, de douleur abdomino-pelviennes, voire d’une occlusion intestinale. (4)
Conclusion
L’extrême rareté des complications liées à la pose des DIU ne doit pas alarmer inutilement les patientes mais justifie que l'information soit délivrée.
Celles-ci doivent également connaître les motifs devant les amener à consulter.
Devant une symptomatologie inhabituelle, l’échographie pelvienne est l’examen de première intention pour localiser le DIU.
En cas de non-visualisation un ASP est indiqué.
Il n’existe pas de réel seuil échographique de distance entre le DIU et le fond utérin, l’endomètre ou le myomètre pour affirmer le bon positionnement du dispositif.
Chez une patiente asymptomatique, aucune donnée ne permet d’affirmer que le retrait d’un DIU bas situé est une meilleure attitude que de le laisser en place.
En cas de résistance au retrait d’un DIU (enchâssé ou non), un guidage hystéroscopique peut s’avérer utile.
Les perforations complètes des DIU sont rares (environ 1 pour 1000) et nécessitent le plus souvent une prise en charge par coelioscopie ou par laparotomie (plus rarement). L’expectative peut favoriser des complications secondaires, parfois responsables de lésions d’organe de voisinage (digestives entres autres), d’infertilité, de douleurs abdomino-pelviennes, voire d’une occlusion intestinale.
Le fort niveau d’efficacité des DIU lié à leur bonne tolérance, durée d’action, et sécurité d’utilisation, justifie leur utilisation quel que soit l’âge et la parité.
Référence bibliographiques
(1) Vidal F, et al. Contraception intra-ute ́rine. RPC Contraception CNGOF. Gynecologie Obste ́trique Fertilite ́ & Senologie (2018), https://doi.org/10.1016/j.gofs.2018.10.004
(2) David K. Turok, Shawn E. Gurtcheff, Keri Gibson, Erin Handley, Sara Simonsen, Patricia A. Murphy. Operative management of intrauterine device complications: a case series report. Contraception 82 (2010) 354–357
(3) Mira Harrison-Woolrych, Janelle Ashton, David Coulter. Uterine perforation on intrauterine device insertion: is the incidence higher than previously reported. Contraception 67 (2003) 53–56
(4) P. Faucher, D. Hassoun; Morbidité des dispositifs intra-utérins. 38e journée du collègue national des gynécologues et obstétriciens français (2014). 7e partie : Orthogénie.
(5) Kulier R, O’Brien P, Helmerhorst FM, Usher-Patel M, d’Arcangues C. Copper containing, framed intra- uterine devices for contraception. Cochrane Database of Systematic Reviews 2007, Issue 4. Art.
(6) Heinemann K, Reed S, Moehner S, Minh TD. Risk of uterine perforation with levonorgestrel-releasing and copper intrauterine devices in the European Active Surveillance Study on Intrauterine Devices. Contraception 2015;91(4):274–9.
(7) Kaislasuo J, Suhonen S, Gissler M, Lahteenmaki P, Heikinheimo O. Intrauter- ine contraception: incidence and factors associated with uterine perforation– a population-based study. Hum Reprod 2012;27(9):2658–63.
(8) Kerstin Andersson,Elsa Ryde-Blomqvist,Kerstin Lindell,Viveca Odlind, and Ian Milsom. Perforations With Intrauterine Devices. Report From a Swedish Survey. Contraception 1998;57:251–255
(9) Kari P. Braaten, Carol B. Benson, Rie Maurer, and Alisa B. Goldberg. Malpositioned Intrauterine Contraceptive Devices. Risk Factors, Outcomes, and Future Pregnancies. Obstetrics & Gynecology. Vol. 118, No. 5, 2011
(10) M.W. Steenland et al. Intrauterine contraceptive insertion postabortion: a systematic review. Contraception 84 (2011) 447–464
(11) Recommandations de l’Organisation mondiale de la santé (OMS, 2009), du Centers for Disease Control (CDC, 2010) et de la Faculty of Sexual and Reproductive Healthcare (FSRH, 2009), le DIU au LNG est utilisable dès 4 semaines après l’accouchement.
(12) HAS. Recommander les bonnes pratiques. Fiche Contraception chez la femme en post-partum. Validée par le Collège le 24 avril 2013. Mis à jour en juil. 2019. URL : https://www.has-sante.fr/upload/docs/application/pdf/2015-02/1e_maj-contraception-post-partum-060215.pdf
(13) C. Boyon, G. Giraudet, B. Guerin Du Masgenêt, J.-P. Lucot, P. Goeusse, D. Vinatier. Diagnostic et prise en charge des perforations utérines par dispositif intra-utérin : à partir de 11 cas. Gynécologie Obstétrique & Fertilité. 41 (2013) 314–321
(14) C. Barnett, K. Heinemann and al. EURAS - Intrauterine Devices and the Risk of Uterine Perforations: Interim Results from the EURAS - IUD Study. 2012.
(15) Norman D Goldstuck, Dirk Wildemeersch. Role of uterine forces in intrauterine device embedment, perforation, and expulsion. International Journal of Women’s Health 2014:6 735–744.
(16) Rowe P, Farley T, Peregoudov A, Piaggio G, Boccard S, Landoulsi S, et al. Safety and efficacy in parous women of a 52-mg levonorgestrel-medicated intra- uterine device: a 7-year randomized comparative study with the TCu380A. Contraception 2016;93(6):498–506.
(17) Boutaina Lachiri1,&, Moulay Rachid Hafidi1, Abdelgheni Zazi1, Houda Fagouri1, Jaouad Kouach1, Driss Moussaoui Rahali1, Mohamed Dehayni1 Le stérilet migrateur : à propos de deux cas et revue de la littérature. Pan African Medical Journal 2014; 19:361
(18) Richdeep S. Gill, Dereck Mok, Matthew Hudson, Xinzhe Shi, Daniel W. Birch, Shahzeer Karmali. Laparoscopic removal of an intra-abdominal intrauterine device : case and systematic review. Contraception 85 (2012) 15–18
(19) Ranjeet Brar, Sudeendra Doddi, Anand Ramasamy, and Prakash Sinha. A Forgotten Migrated Intrauterine Contraceptive Device Is Not Always Innocent: A Case Report. Case Reports in Medicine. Volume 2010, Article ID 740642, 3 pages
(20) Mahmut T. Ozgun, Cem Batukan, Ibrahim S. Serin, Bulent Ozcelik, Mustafa Basbug, Mehmet Dolanbay. Surgical management of intra-abdominal mislocated intrauterine devices. Contraception 75 (2007) 96–100
(21) HAS - Direction de l'Evaluation Médicale, Economique et de Santé Publique. Commission de la transparence. Avis 8 février 2017. URL : https://www.has-sante.fr/upload/docs/evamed/CT-15139_MIRENA_PIC_REEV_Av…