L’endométriose externe touche environ 10 à 15% des femmes en âge de procréer, 5 à 50 % des femmes infertiles, et 5 à 21 % des femmes hospitalisées présentant des douleurs pelviennes. C’est une pathologie qui survient chez la femme jeune, en général entre 17 ans et 37 ans, mais plus particulièrement entre 17 et 30 ans, et les adolescentes peuvent être touchées : 5 à 10 % des adolescentes présenteraient de l’endométriose, en particulier chez 75 % des adolescentes présentant des dysménorrhées résistantes aux traitements médicaux. Les facteurs de risque sont peu nombreux et incertains puisque leur risque relatif est d’environ 2 : histoire familiale avec une mère et une sœur ayant présenté une endométriose, âge précoce des premières règles, durée courte du cycle menstruel, abondance importante du flux menstruel, et exposition à des perturbateurs endocriniens, en particulier le PCB ou la dioxine.
On distingue l’endométriose externe superficielle, où les lésions sont péritonéales et non infiltrantes, de l’endométriose profonde (infiltrant les ligaments, les ovaires et/ou les organes intra-abdominaux).
Physiopathologie
Depuis la théorie de Sampson (1921), l’endométriose était expliquée par le reflux menstruel tubaire et intra-abdominal qui survient chez toutes les femmes au moment de leurs règles. Ainsi se déposent sur le péritoine et/ou les organes des débris d’endomètre, que 90% des femmes parviennent à éliminer. Actuellement, plusieurs auteurs pensent que l’endométriose se développe à partir de cellules endométriales primitives présentes en dehors de l’utérus dès la période d’organogénèse, expliquant que des caractéristiques génétiques/épigénétiques conduisent à des formes familiales de cette maladie. Après la puberté, en raison d’altérations immunitaires, de perturbateurs endocriniens et d’un environnement péritonéal pro-inflammatoire lié au reflux menstruel (radicaux libres de l’oxygène, microbiome), ces cellules endométriales évolueraient par un développement clonal et hétérogène vers des implants endométriosiques [1]. Secondairement, une diminution de la croissance cellulaire induirait une fibrose progressive de ces lésions [2] (figure 1).
Figure 1 : Théorie physiopathologique actuelle de l’endométriose externe, d’après [2]
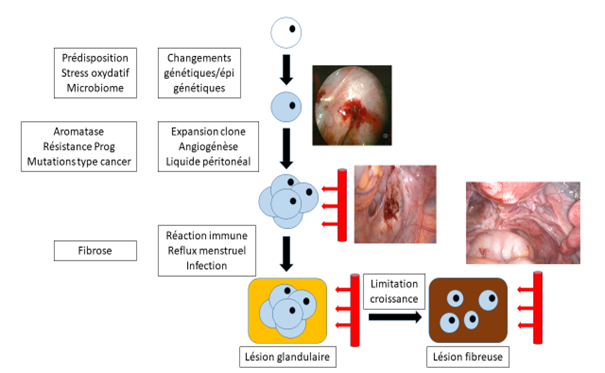
D’autres auteurs suggèrent que les localisations extra-péritonéales d’endométriose (pleurale, méningée) proviennent de la migration circulatoire de cellules souches médullaires, en raison d’un profil épigénétique favorable, se différenciant en cellules endométriosiques [3]. Les cellules endométriosiques vont acquérir une autonomie, par une aromatase permettant la synthèse locale d’œstrogènes, une résistance à la progestérone par méthylation du récepteur à la progestérone, des mutations de type cancer, une capacité invasive, une néo-angiogénèse, et une propre neurogénèse avec des anastomoses au système nerveux autonome et à la moelle épinière puis au cerveau créant un véritable arc vicieux douloureux. Autour de ces lésions endométriosiques, une réaction inflammatoire à base de prostaglandines et de radicaux libres surviendra expliquant les douleurs, et une fibrose périphérique entrainera la rétraction des tissus et l’apparition d’adhérences.
Diagnostic
Le diagnostic clinique de l’endométriose repose sur les 5 D, c'est-à-dire :
- La dysménorrhée, typiquement du 3ème/4ème jour des règles.
- La dyspareunie profonde positionnelle.
- Les douleurs pelviennes chroniques.
- Les attentes urinaires avec la dysurie, la pollakiurie, des mictions impérieuses, voire une hématurie.
- Les atteintes digestives avec des ténesmes, des troubles du transit, et des rectorragies.
Tous ces signes sont en général majorés par les règles. Il n’y a pas de corrélation entre l’importance des lésions d’endométriose et les signes cliniques que peut présenter la femme. Ce qui importe dans nos consultations c’est de relever la qualité de vie de ces patientes, aussi bien dans la vie de tous les jours, que dans leur vie sexuelle.
Pour aider le praticien, des questionnaires existent, le plus connu est l’EHP-5, qui est coté de 0 à 44 (réponses : jamais = 0, rarement = 1, parfois = 2, souvent = 3, et toujours = 4). Chapron a publié en 2022 [4] la validation du diagnostic d’endométriose à partir d’un questionnaire, où il a montré qu’un certain nombre d’items étaient indicatifs d’une endométriose : échelles analogiques sur la douleur, la dysménorrhée, la dyspareunie profonde, les symptômes urinaires, l’absentéisme scolaire ou professionnel, la prescription d’oestroprogestatifs, l’existence de rectorragie ou d’hématurie, le faible poids de naissance, la nulliparité, l’infertilité primaire, un IMC inférieur à 22, un Rhésus négatif, ou une histoire familiale d’endométriose. Cette validation a permis l’établissement d’une courbe ROC montrant une aire sous la courbe entre 0,75 et 0,81.
Toujours dans le dépistage le plus précoce possible de l’endométriose, les recherches portent sur les patterns d’histones, la méthylation des gènes et les microARN circulants. La dérégulation de ces microARN jouerait un rôle dans l’endométriose modulant l’inflammation, la prolifération, l’angiogenèse, et le remodelage tissulaire observé dans cette pathologie. Une étude prospective française menée par Bendifallah en 2022 [5], sur un panel de 109 microRNA (ENDO – miRNA), a été réalisée chez 153 femmes présentant une endométriose, et 47 sans endométriose, montrant une sensibilité, une spécificité, une aire sous la courbe très encourageantes, respectivement 96,7%, 100% et 98,3%. Parmi ces microRNA certains avaient déjà été recherchés dans l’endométriose, d’autres étaient impliqués dans des mécanismes de signalisation cellulaire bien connus. Il existe actuellement une étude complémentaire, et une demande de commercialisation de l’Endotest.
Traitement
En ce qui concerne le traitement médical, le but est de supprimer les règles, ce qui est possible avec une pilule monophasique oestroprogestative en continu, un stérilet au lévonorgestrel, les progestatifs, voire les agonistes de la GnRH. Ces traitements sont plus ou moins efficaces sur la douleur et l’arrêt de la progression des lésions, cependant ils ont des effets secondaires : prise de poids, hypo-oestrogénie, risque thrombotique.
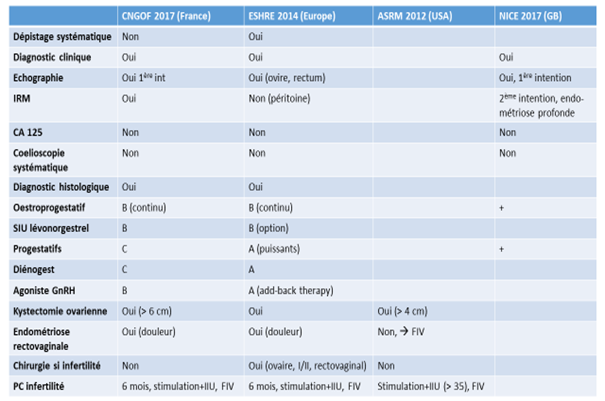
Le diénogest semble être intéressant et actuellement classé en 2ème intention au niveau des recommandations françaises du CNGOF, mais probablement demain en 1ère intention (figure 2).
Figure 2 : Recommandations françaises, européennes, américaines et britanniques sur l’exploration et la prise en charge de l’endométriose
L’efficacité du diénogest versus placebo a été démontré par l’étude de Strowitzki en 2010 (diminution de 50% des douleurs), avec un bénéfice persistant après l’arrêt. Kashi en 2021 avait montré un effet comparable du diénogest par rapport à la pilule oestroprogestative en continu sur la qualité de vie et la dyspareunie, et Harada en 2008 avait rapporté, versus agoniste de la GnRH, une évaluation des douleurs et de la qualité de vie comparable, sans les effets secondaires des agonistes de la GnRH. Chez les adolescentes le diénogest peut être prescrit, mais il faut savoir qu’il existe une petite diminution de la minéralisation osseuse du rachis, récupérée 6 mois après l’arrêt. Plus intéressant, le diénogest semble montrer une diminution du volume des endométriomes par rapport aux oestroprogestatifs, et une prévention des récidives. Dans l’étude d’Uludag en 2021 la diminution était d’environ 40% du volume de ces endométriomes.
Mais attention, le diénogest n’a jamais été testé comme une contraception, et s’il est associé à l’éthynil-œstradiol, il présente un risque thrombotique égal aux progestatifs de 3ème génération.
Ainsi, si une contraception est souhaitée, le diénogest peut être associé soit à des préservatifs, un implant, des microprogestatifs, ou un stérilet au lévonorgestrel.
L’avenir passe peut-être par la mutation qui a été découverte du gène NPSR1, présent chez 11,3% des femmes, dans les cellules endométriales et les monocytes péritonéaux. Une étude [6] a été menée chez des femmes souffrant d’endométriose, où il existe un variant de ce gène qui entraine une stimulation de l’inflammation locale, surtout dans les stades III et IV. Il existe un inhibiteur de ce gène qui a été testé chez la souris, avec une diminution significative de l’inflammation en cas d’endométriose.
Rappelons qu’il n’existe pas à ce jour de traitement médical détruisant les lésions d’endométriose installée.
Toujours dans le cadre des traitements, les ultrasons focalisés par échographie permettraient de détruire par la chaleur les lésions d’endométriose. Cela avait déjà été testé sur les fibromes, c’est désormais appliqué à Lyon par le Pr Dubernard sur les lésions d’adénomyose, avec une amélioration de la dysménorrhée, et sur les nodules du torus utérin, pouvant faire penser que si cette technique est validée, elle puisse être généralisée avec probablement un HIFU Center dans chaque région française.
Grossesse et endométriose
Dans une étude réalisée en Australie en 2022 [7], l’auteur sépare les femmes en 4 groupes : un groupe sans endométriose et sans Assistance Médicale à la Procréation qui représente le groupe référence, un groupe avec AMP, un groupe avec une endométriose et AMP, et le dernier groupe avec endométriose sans AMP. La pratique d’une AMP va entrainer des accouchements prématurés, et un plus petit poids de naissance de façon significative. Lorsqu’une endométriose existe sans AMP, on note une augmentation de l’accouchement prématuré, et lorsque cette endométriose est associée à une AMP, on retrouve l’accouchement prématuré, mais inférieur à 37 semaines d’aménorrhée. En ce qui concerne les pathologies de la grossesse, l’AMP est responsable des placentas prævia, des hématomes rétroplacentaires, des hémorragies antépartum, des déclenchements et de la morbidité maternelle. Lorsqu’il existe une endométriose sans AMP, on retrouve les placentas prævia, l’hémorragie antépartum, et les accouchements déclenchés. Lorsque l’endométriose est associée à l’AMP, on ne retrouve que les hémorragies antépartum.
Une autre étude de Lafleur en 2022 [8] menée au Québec, avait montré une morbidité maternelle sévère dans l’endométriose à 46/1000 vs 30/1000 sans endométriose. Si l’endométriose est active pendant la grossesse, cette morbidité augmente de façon très importante (+ 93%), en particulier sous forme de pré-éclampsie, d’éclampsie sévère, d’hémorragie, d’hystérectomie du post-partum, de complications cardiaques, d’embolie, de choc septique, et d’admission en soins intensifs.
Les réseaux
Désormais, selon les directives du ministère de la Santé, la constitution d’un réseau régional de prise en charge de l’endométriose est obligatoire, basé sur des professionnels de soins primaires et de soins secondaires, appartenant à des structures de soins secondaires ou tertiaires, ce qui va permettre d’organiser la prise en charge globale de cette maladie. Nous avons créé le nôtre en Bretagne et nous vous invitons à le découvrir et à y adhérer via notre site internet (www.endobreizh.com).
Références
- Laganà AS, Vitale SG, Salmeri FM, Triolo O, Ban Frangež H, Vrtačnik-Bokal E, et al. Unus pro omnibus, omnes pro uno: A novel, evidence-based, unifying theory for the pathogenesis of endometriosis. Med Hypotheses 2017;103:10-20.
- Koninckx PR, Fernandes R, Ussia A, Schindler L, Wattiez A, Al-Suwaidi S, et al. Pathogenesis Based Diagnosis and Treatment of Endometriosis.. Front Endocrinol (Lausanne) 2021; 12:745548.
- Pluchino N, Taylor HS. Endometriosis and Stem Cell Trafficking. Reprod Sci 2016;23:1616-9.
- Chapron C, Lafay-Pillet MC, Santulli P, Bourdon M, Maignien C, Gaudet-Chardonnet A, et al. A new validated screening method for endometriosis diagnosis based on patient questionnaires. The Lancet.com 2022;44:101263. doi: 10.1016/j.eclinm.2021.101263.
- Bendifallah S, Suisse S, Puchar A, Delbos L, Poilblanc M, Descamps P, et al. Salivary MicroRNA Signature for Diagnosis of Endometriosis. J Clin Med 2022;11:612.
- Tapmeier TT, Rahmioglu N, Lin J, De Leo B, Obendorf M, Raveendran M, et al. Neuropeptide S receptor 1 is a nonhormonal treatment target in endometriosis. Sci Transl Med 2021;13:eabd6469. doi: 10.1126/scitranslmed.abd6469.
- Ibiebele I, Nippita T, Baber R, Torvaldsen S. Pregnancy outcomes in women with endometriosis and/or ART use: a population-based cohort study. Hum Reprod 2022;37:2350-8.
- Lafleur N, Wei SQ, Bilodeau-Bertrand M, Auger N. Association of Endometriosis and Severe Maternal Morbidity. Obstet Gynecol 2022;140:1008-1016.



