Une analyse de la littérature (analyses et commentaires des articles)
High-dose folic acid supplementation alters the human sperm methylome and is influenced by the MTHFR C677T polymorphism
Hum Mol Genet. 2015; 24:6301-13.
Mahmoud Aarabi 1, Maria C San Gabriel 2, Donovan Chan 3, Nathalie A Behan 4, Maxime Caron 5, Tomi Pastinen 5, Guillaume Bourque 5, Amanda J MacFarlane 4, Armand Zini 2, Jacquetta Trasler 6
Testicular MTHFR deficiency may explain sperm DNA hypomethylation associated with high dose folic acid supplementation
Hum Mol Genet. 2018 Apr 1; 27(7): 1123–1135. Published online 2018 Jan 19. doi: 10.1093/hmg/ddy021
Mahmoud Aarabi,1,2 Karen E Christensen,2 Donovan Chan,2 Daniel Leclerc,2 Mylène Landry,2 Lundi Ly,1,2 Rima Rozen,1,2,3 and Jacquetta Trasler1,2,3,4
Cela fait maintenant quelque temps que l’analyse du sperme selon les paramètres classiques du spermogramme, à savoir numération, concentration vitalité et formes typiques, même s’ils sont nécessaires, ne représentent qu’une partie des causes de la stérilité masculine. Les anomalies de structure secondaire et tertiaire de l’ADN du spermatozoïde (fragmentation et décondensation) ont pris une place importante, démontrant souvent que l’ICSI n'est pas une méthode miracle.
La fragmentation de l’ADN du spermatozoïde, souvent liée au stress oxydant, peut être réparée par l’ovocyte, jusqu’à une certaine limite. Tandis que l’accomplissement de la structure tertiaire (condensation) qui correspond au remodelage de la chromatine ne peut pas être réparée par l’ovocyte. Ces éléments sont nécessaires à la mise en place partielle de l’épigénome pour permettre un parfait timing des premières divisions embryonnaires (Ward 2010, Kutchy, 2019).
Les analyses biochimiques et moléculaires ont mis clairement en évidence le rôle des aspects épigénétiques parmi les causes de l’infertilité masculine. Il s’agit essentiellement des processus de méthylation des histones et de l’ADN des spermatozoïdes. Pour l’ADN cette méthylation concerne la cytosine au niveau des séquences CpG (Cytosine phosphate Guanine), appelés ilots CpG. Nous présentons ici les observations qui confirment cette importance et le rôle joué par deux cycles biochimiques d’importance majeure, le cycle des folates et celui de la méthionine. Nous analysons également l’impact d’un traitement par l’acide folique chez l’homme qui est sensé améliorer la qualité du sperme (par son entrée dans le cycle des folates et de la méthionine) et l’impact d’un traitement par l’acide folique chez la femme enceinte avec les conséquences sur la spermatogenèse future de l’enfant (via entre autres par l’analyse des publications de Aarabi M.)
Paramètres de l’étude
30 patients normospermiques mais présentant une infertilité idiopathique ont été étudiés (dosage des folates, profil de méthylation de l‘ADN spermatique et analyse des paramètres classique du sperme) avant et après la prise de doses élevées d’acide folique pendant 6 semaines.
La méthylation de l’ADN a été étudiée par « Bisulfite Pyrosequencing » avant et après traitement.
Le dosage des folates dans les érythrocytes (RBC) est réalisé par la méthode microbiologique avec Lactobacillus casei. Cette méthode est globale et ne permet pas l’individualisation/identification des différents dérivés de l’acide folique. Elle dose donc aussi l’acide folique circulant non métabolisé : UMFA (UnMetabolized folic acid). L’acide folique est un composé synthétique qui doit être métabolisé avant d’entrer dans le cycle des folates. Il a une faible capacité à être métabolisé du fait de deux blocages : au niveau de son entrée dans le cycle des folates (faible activité de la protéine DHFR ; Di-Hydro-Folate-Reductase) puis au niveau de la protéine MTHFR (Methyl-Tetra-Hydro-Folate-Reductase) chez les patients mutés pour ce gène. Il en résulte une accumulation d’acide folique non métabolisé qui freine voire bloque le cycle des folates (par le mécanisme biochimique connu d’excès de substrat), favorisant même parfois une montée d’homocysteine (effet inverse de ce qui est souhaité).
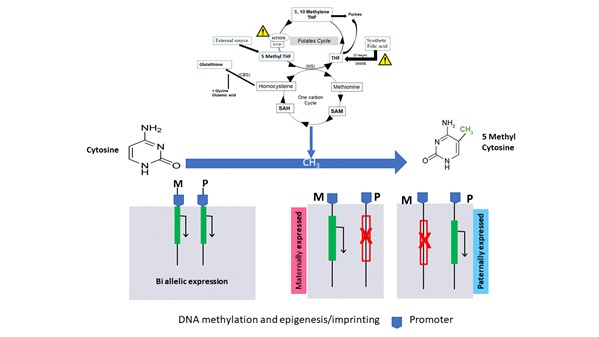
Figure 1
Relation, entre épigénèse/empreinte, la méthylation de l’ADN et le cycle de la méthionine
(1-CC One carbon cycle) et des folates
Résultats de l’étude :
Augmentation des « folates » sous Acide Folique : Sans surprise, la consommation d’acide folique augmente les « folates », y compris l’UMFA, dans les globules rouges. Cette observation est observée pour les porteurs ou non de la mutation (isoforme) MTHFR (méthylène TetraHydroFolate Réductase) C677T. Il est très probable que cette augmentation est principalement liée à l’augmentation de l’UMFA. Les autres paramètres biochimiques, dont l’homocysteine (Hcy) ne sont pas modifiés. Le taux d’homocysteine n’est pas abaissé par cet apport d’acide folique comme on pourrait s’y attendre, et notamment chez les patients mutés où il est de base plus élevé (Clement et al, 2022).
Pas d’amélioration de paramètres spermatiques après traitement par l’acide folique : Plus important, les paramètres classiques du sperme (volume, mobilité et décondensation) ne sont pas améliorés par ce traitement, que les patients soient porteurs du variant C677T ou non, l’isoforme mutée du gène MTHFR (677TT) étant connue pour affecter, selon les méta-analyses effectuées, tous les paramètres du sperme (Gong et al. 2015). Le but d’une amélioration des paramètres du sperme n’est donc pas obtenu par cet apport d’acide folique.
Modification du profil de méthylation de l’ADN spermatique après traitement à l’acide folique : La méthylation des régions soumises à empreinte parentales ; que ce soit pour la méthylation paternelle (H19, DLK1/GTL2 IG-DMR) ou maternelle (KCNQ10T1, PLAG1, MEST, SNRPN) n’est pas modifiée.
Par contre, l’apport important d’acide folique produit une déméthylation globale de l’ADN des spermatozoïdes, notamment au niveau des régions CpG inter-géniques, des régions répétées de l’ADN comme les microsatellites, les transposons et les rétrotransposons ; induisant une instabilité de l’ADN (Duthie et al., 2002). Cette diminution de la méthylation est exacerbée chez les porteurs de l’isoforme MTHFR 677TT.
Les fortes doses d’acide folique peuvent aussi modifier la méthylation des promoteurs de gènes suppresseurs de tumeur ou de gènes impliqués dans des pathologies psychiatriques/comportementales, du développement, de l’obésité et de pathologies cardiovasculaires.
Ces données sont d’autant plus importantes que ces modifications épigénétiques sont trans-générationnelles et qu’elles peuvent avoir une implication sur plusieurs générations.
Discussion et conclusion :
Il n’est pas question de mettre en doute l’intérêt de l’acide folique de synthèse (acide pteroyl Glutamique), notamment dans l’évitement des défauts de fermeture du tube neural. C’est plutôt l’intérêt et les conséquences possibles de la fortification qui commencent à apparaitre dans la littérature scientifique (Murphy & Westmark 2020), notamment quant aux risques de cancer (Hirsch et al. 2009). L’acide folique est mal métabolisé (Bayley & Ayling 2009) et la fortification conduit à une circulation permanente d’UMFA (acide folique non métabolisé) qui interfère et entre en compétition avec le folate naturel actif 5MTHF (5-MethylTetraHydrofolate) qui ainsi ne peut plus pleinement assurer sa fonction. L’UMFA est d’ailleurs retrouvé dans le sang de cordon et dans le sang du nouveau-né (Pfeiffer et al. 2015 ; Raghavanrag et al.2020) .
Compte tenu de cette problématique de compétition avec le folate naturel, cet aspect est critique, potentiellement dangereux au moment de la mise en place du marquage d’empreinte et d’épigénèse dans l’embryon humain. Cette observation sera encore plus cruciale chez les enfants porteurs des mutations (C677T et A1298C) du gène MTHFR.
Par ailleurs, il n’est pas illogique de penser que l’UMFA soit la cause des anomalies de marquage épigénétique dans la lignée germinale au cours du développement embryonnaire de l’embryon de sexe masculin : elles se retrouveront dans le sperme de l’adulte. Et a fortiori, l’acide folique cause du problème ne peut être l’élément « réparateur » ; conclusion que l’on peut tirer des travaux de Araabi M et al.
L’acide folique à forte dose n’est donc pas un traitement recommandable, chez l’homme, surtout chez les porteurs des variants MTHFR chez qui le sperme est altéré (Gong et al.2015).
Chez la femme, la littérature scientifique se montre de plus en plus concernée par les conséquences chez l’enfant. En effet, se surajoutent deux effets négatifs dans le cas de fortification alimentaire (Christensen et al. 2015 ; Valera Gran et al. 2017, Pauwels et al. 2017, Leclerc et al. 2021) : les risques psychomoteurs et surtout les risques de défauts (épigénétique et empreinte) affectant la lignée germinale du garçon qui sera inéluctablement plus tard un facteur péjoratif pour le sperme (Blake et al. 2021, Ménézo et al. 2022).
L’acide folique de synthèse est un outil puissant qui n’a pas que des avantages : l’impact sur la régulation de la méthylation est trop important pour que l’on se tienne au concept « One size fits all » : même dose/même traitement pour tous. Les fortes doses supérieures à 1 mg/jour doivent être proscrite, en utilisation longue. Par ailleurs, le problème des variants MTHFR doit être pris en compte et l’utilisation du 5-MTHF (5 Methyl Tetrahydrofolate) qui est efficace (Clément et al. 2020, Handerson et al. 2018)) et qui ne génère pas d’accumulation de composés non métabolisés (Troesch et al. 2019) doit être préconisée plutôt que l’acide folique ; les doses efficaces de 5-MTHF étant bien moindres et plus physiologiques que les fortes doses d’acide folique.
Bibliographie
Bailey S. & Ayling, J.E. The extremely slow and variable activity of dihydrofolate reductase in human liver and its implications for high folic acid intake.Proc Natl Acad Sci U S A. 2009 ;106:15424-9
Blake, G., Zhao, X., Yung, H. W., Burton, G. J., & Ferguson‐Smith, A. C. (2021). Defective folate metabolism causes germline epigenetic instability and distinguishes Hira as a phenotype inheritance biomarker. Nature Communications, 12 (1), 3714.
Clément A.; Menezo Y. ; Cohen, M. ; Cornet, D. ; Clément, P. 5-Methyltetrahydrofolate reduces blood homocysteine level significantly in C677T methyltetrahydrofolate reductase single-nucleotide polymorphism carriers consulting for infertility. J Gynecol Obstet Hum Reprod. 2020; 49:101622.
Christensen KE, Mikael LG, Leung KY, Lévesque N, Deng L, Wu Q, Malysheva OV, Best A, Caudill MA, Greene ND, Rozen R. High folic acid consumption leads to pseudo-MTHFR deficiency, altered lipid metabolism, and liver injury in mice. Am J Clin Nutr. 2015 ;101:646-58
Duthie S. Narayanan S., Brand G., Pirie L., Grant G. Impact of folate deficiency on DNA stability. J Nutr. 2002;132(8 Suppl):2444S-2449S
Gong M., Dong W., He T., Shi, Z.; Huang G. MTHFR 677C>T polymorphism increases the male infertility risk: a meta-analysis involving 26 studies. PLoS One. 2015;10: e0121147.
Henderson, A.M.; Aleliunas, R.E.; Loh, S.P.; Khor, G.L.; Harvey-Leeson, S. 5-Methyltetrahydrofolate Supplementation Increases Blood Folate Concentrations to a Greater Extent than Folic Acid Supplementation in Malaysian Women. J Nutr. 2018 ; 148: 885-890.
Hirsch S., Sanchez H. Albala C., de la Maza M.P., Barrera G., Leiva,L. , Bunout D. Colon cancer in Chile before and after the start of the flour fortification program with folic acid. Eur J Gastroenterol Hepatol. 2009; 21:436-9.
Kutchy, NA, Menezes, ESB, Ugur, MR, Ul Husna, A, ElDebaky, H, Evans, HC, Beaty, E, Santos, FC, Tan, W, Wills, RW, Topper, E, Kaya, A, Moura, AA and Memili, R (2019). Sperm cellular and nuclear dynamics associated with bull fertility. Anim Reprod Sci 211, 106203.
Leclerc D, Jelinek J, Christensen KE, Issa JJ, Rozen R. High folic acid intake increases methylation-dependent expression of Lsr and dysregulates hepatic cholesterol homeostasis. J Nutr Biochem. 2021; 88:108554.
Menezo, Y., Clement, P., & Elder, K. (2022). Are UMFA (un‐metabolized folic acid) and endocrine disruptor chemicals (EDCs) co‐responsible for sperm degradation? An epigenetic/methylation perspective. Andrologia, 00, e14400.
Murphy ME, Westmark CJ Folic Acid Fortification and Neural Tube Defect Risk: Analysis of the Food Fortification Initiative Dataset.Nutrients. 2020; 12:247.
Pauwels S, Ghosh M, Duca RC, Bekaert B, Freson K, Huybrechts I, Langie SAS, Koppen G, Devlieger R, Godderis L.Maternal intake of methyl-group donors affects DNA methylation of metabolic genes in infants. Clin Epigenetics. 2017; 9:16.
Pfeiffer, C.M.; Sternberg, M.R.; Fazili Z.; Yetley, E.A.; Lacher, D.A. et al. Unmetabolized folic acid is detected in nearly all serum samples from US children, adolescents, and adults.J Nutr. 2015 ; 145:520-31.
Raghavanrag, R, Selhub, J,Paul, L, Ji, Y, Wang, G. et al. A prospective birth cohort study on cord blood folate subtypes and risk of autism spectrum disorder. Am J Clin Nutr. 2020; 112:1304-1317
Valera‐Gran, D., Navarrete‐Muñoz, E. M., Garcia de la Hera, M., Fernández‐Somoano, A., & Tardón, A. INMA project eect of maternal high dosages of folic acid supplements on neurocognitive development in children at 4‐5 y of age: The prospective birth cohort Infancia y Medio Ambiente (INMA) study. The American Journal of Clinical Nutrition, 2017, 106: 878‐887.
Ward, WS (2010). Function of sperm chromatin structural elements in fertilization and development. Mol Hum Reprod 16, 30–6.





