Introduction
Les anomalies de l’insertion placentaire sont en grande majorité découvertes au moment de l’accouchement ou de la délivrance (1-2). Cette situation est responsable d’une augmentation significative du risque de morbidité et mortalité maternelle (3). les anomalies de l’insertion placentaire constituent la première cause d’hystérectomie d’hémostase, et sont associées à un risque élevé de complications chirurgicales, notamment plaies de vessie, vasculaire et du tube digestif (4).
Le diagnostic anténatal de ces anomalies constitue donc un enjeu de santé publique. Selon le rapport du Comité National Technique de l'échographie de dépistage prénatal, l’échographie de dépistage permet de réduire la mortalité maternelle grâce au dépistage du placenta praevia et du placenta accreta (5).
Le comité d’opinion dédié au placenta accreta de l’American College of Obstetricians and Gynecologists a récemment rapporté que l’incidence du placenta accreta aurait été multipliée par 10 au cours des cinquante dernières années, concernant 1 accouchement sur 2500 (6). Il s’agit donc d’anomalies graves mais relativement peu fréquentes, et l’objectif du dépistage est d’abord d’identifier les patientes à risque, puis dans un second temps de soumettre celles-ci de façon sélective à un dépistage spécialisé et approfondi.
L’interrogatoire : une étape fondamentale
Il a été montré une relation entre l’incidence du placenta accreta et l’âge de la patiente, le nombre de cicatrices de césarienne et la présence d’un placenta praevia (7). En l’absence de cicatrices, chez une patiente de moins de 35 ans sans placenta praevia, le risque de placenta accreta est de 2%. Inversement, avec deux cicatrices ou plus et un placenta praevia, une patiente de plus de 35 ans a un risque de placenta accreta de 40% (7)
L’interrogatoire et l’examen clinique représentent donc une étape essentielle du dépistage. Une étude a montré que sensibilité, spécificité et valeur prédictive négative de l’échographie utérine vis-à-vis du placenta accreta sont beaucoup moins élevées que les chiffres issus de la littérature et cités ci-dessous lorsque l’opérateur ne dispose d’aucune information sur les antécédents obstétricaux et le dossier clinique de la patiente (8).
L’échographie : quelques repères simples
Trois points majeurs sont à analyser en échographie : Figure 1 et 2
- Présence du liseré hypoéchogène du myomètre
- Visualisation de l’interface vésicale hyperéchogène
- Image échographique homogène du placenta.
Lorsque ces trois caractéristiques sont présentes, le risque d’anomalie d’insertion placentaire est plus faible.
A l’inverse, les observations suivantes doivent faire suspecter la possibilité d’anomalie d’insertion placentaire: Figure 3
- Disparition du liseré hypoéchogène du myomètre
- Perte de l’interface hyperéchogène vésicale
- Image placentaire hétérogène avec présence de lacunes
- Présence de nodules extra-utérins (en rapport avec un placenta percreta)
Selon Comstock et al (9), La disparition du liseré du myomètre a une sensibilité de 70 à 90%. L’interruption de l’interface vésicale possède une spécificité de 99 à 100%. La présence des lacunes placentaires ont une sensibilité de 70 à 90% et leur absence possède une valeur prédictive négative de 98%. Mais rappelons que ces données concernent des opérateurs sensibilisés à la recherche de l’anomalie et qu’elles sont surestimées en l’absence de ciblage sur les facteurs de risque de trouble de l’insertion placentaire.
L’analyse Doppler peut montrer une vascularisation perpendiculaire au plan du placenta (Figure 4), qui, selon certains auteurs, serait volontiers associée aux troubles de l’insertion placentaire type placenta accreta. Toutefois, une insertion anormale du placenta s’accompagne souvent d’une hypervascularisation placentaire, dense et anarchique, et dont l’orientation diagnostic est difficile à déterminer et à interpréter. Ce point reste encore sujet à controverses et nécessite une évaluation échographique plus précise afin de pouvoir l’utiliser comme outil de dépistage et diagnostic.
Des données récentes suggèrent que l’échographie du premier trimestre pourrait fournir des indicateurs précieux pour repérer la population à risque (10, 11). En effet, il est possible à ce terme de rechercher l’exposition de la cicatrice utérine par rapport au trophoblaste, identifiée en imagerie par le contact entre la cicatrice et le trophoblaste. Pour ce faire, on doit visualiser l’orifice interne du col utérin, la cicatrice utérine et le trophoblaste (Figure 4). Il est montré que, sur une centaine de patientes ayant subi un dépistage approfondi, 6 présentaient une visualisation échographique de l’exposition de la cicatrice utérine par rapport au trophoblaste et l’une d’entre elles était effectivement porteuse d’un placenta accreta (11). Il s’agit là d’une piste prometteuse pour le dépistage des troubles de l’insertion placentaire en population à risque, qui devra être validée par des séries de plus grande envergure et des effectifs plus large.
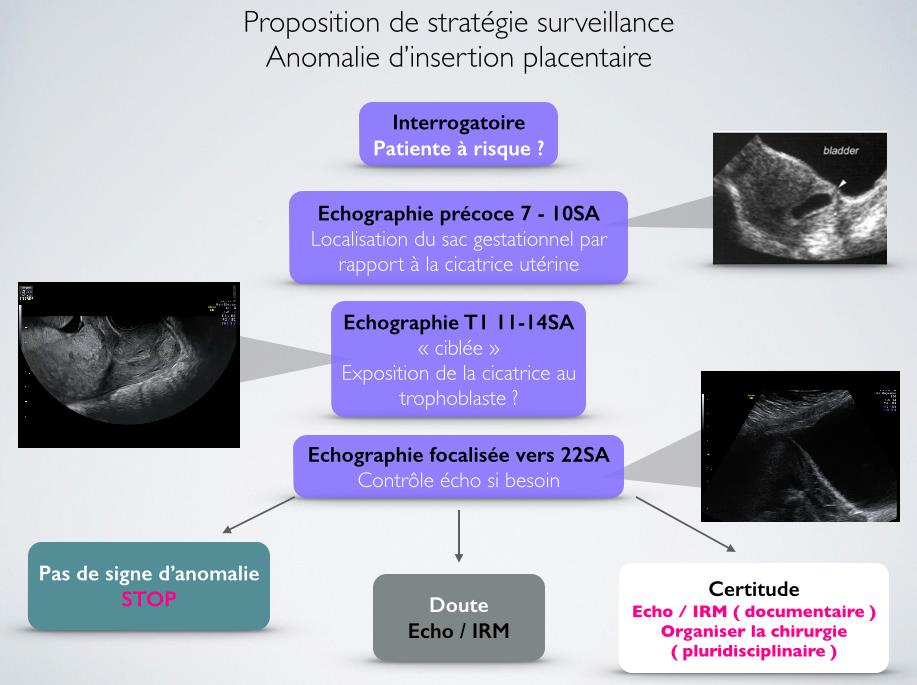
Proposition d’une stratégie de dépistage et de surveillance (figure 6)
L’interrogatoire initiale doit être minutieux à la recherche d’antécédent permettant de classer la patiente dans un groupe à risque.
En cas d’antécédent de césarienne ou de cicatrice utérine, l’échographie précoce de datation entre 7 et 10 semaines d’aménorrhée, permet de localiser le sac gestationnel dans la cavité utérine et ainsi éliminer les risques de grossesse positionnée proche ou dans la cicatrice utérine.
Lors de l’échographie du premier trimestre, entre 11 et 14 semaines d ‘aménorrhée, une analyse focalisée, par voie endovaginale, de la région du trophoblaste et de la cicatrice utérine peut orienter vers une population à risque d’anomalie d’insertion placentaire si le trophoblaste parait exposé à la cicatrice utérine.
En cas de population à risque, les échographies de dépistage du 2ème et 3ème trimestre doivent rechercher les signes d’anomalie d’insertion placentaire. En cas de doute, réaliser une échographie spécialisée de deuxième intention focalisée sur le placenta. En fonction de cet examen échographique, une Imagerie par résonance magnétique peut être proposée pour améliorer le dépistage et affiner l’analyse anatomique de la région utéro-placentaire.
En cas de suspicion d’anomalie de l’insertion placentaire, une prise en charge spécialisée multidisciplinaire doit être mise en œuvre afin d’adapter l’organisation de l’accouchement.
Conclusion
Les anomalies de l’insertion placentaire sont insuffisamment diagnostiquées durant la période anténatale. L’identification des femmes à risque permet de réaliser un dépistage échographique ciblé. Les échographies du premier trimestre semblent actuellement la piste la plus prometteuse en vue d’améliorer la performance du dépistage, de façon à orienter la patiente vers un suivi pluridisciplinaire en milieu spécialisé.
Figure 1 :Echographie en mode 2D, par voie endovaginale focalisée sur le placenta en regard du segment inférieur de l’utérus. Coupe sagittale
Figure 2 : Echographie en mode 2D, par voie endovaginale focalisée sur le placenta en regard du segment inférieur de l’utérus. Coupe sagittale
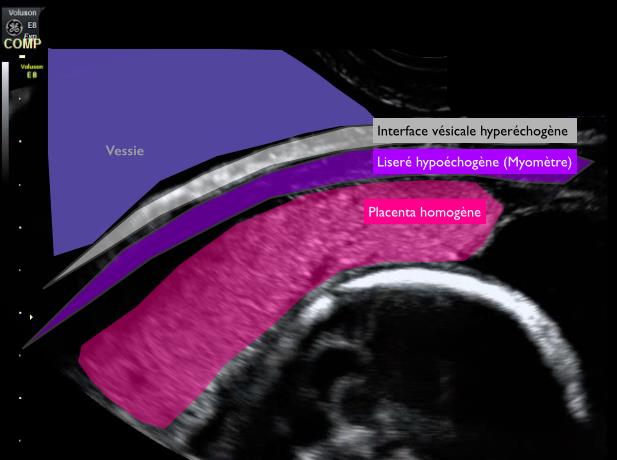
Figure 3: Echographie en mode 2D, par voie abdominale focalisée sur le placenta en regard du segment inférieur de l’utérus. Coupe sagittale avec visualisation des signes d’anomalie de l’insertion placentaire
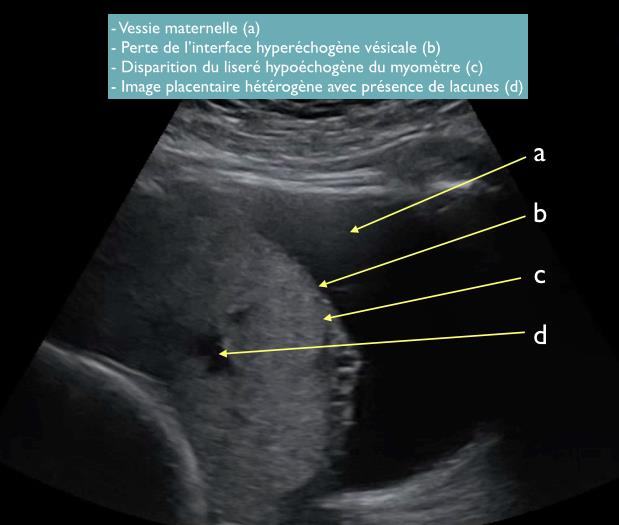
Figure 4 : Echographie en mode 2D couplée au mode Doppler énergie, par voie abdominale focalisée sur le placenta en regard du segment inférieur de l’utérus. Coupe sagittale avec visualisation d’une vascularisation perpendiculaire au plan du placenta.
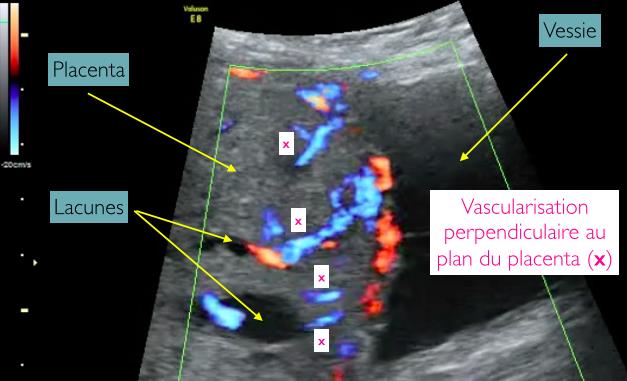
Figure 5 : Echographie au 1er trimestre de la grossesse, en mode 2D, par voie endovaginale focalisée sur le trophoblaste en regard de la cicatrice utérine. Coupe sagittale (Avec les légendes)
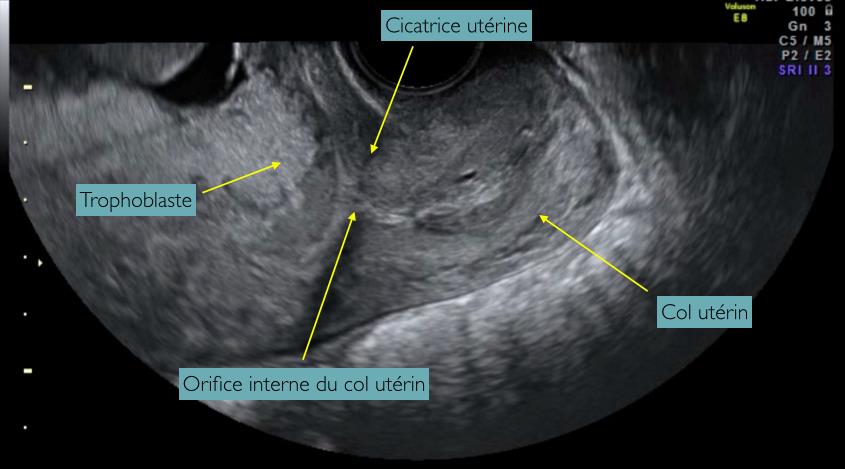
Figure 6 : arbre stratégique de prise en charge des patientes à risque d’anomalie d’insertion placentaire
Bibliographie
-
Briery CM et al. Planned vs emergent cesarean hysterectomy. Am J Obstet Gynecol 2007
-
Eller AG et al. Maternal morbidity in cases of placenta accreta managed by a multidisciplinary care team compared with standard obstetric care. Obstet Gynecol 2011
-
Eller et al. Optimal management strategies for placenta accreta. BJOG 2009.
-
Eller et al. Maternal morbidity in cases of placenta accreta managed by a multidisciplinary care team compared with standard obstetric care. Obstet Gynecol 2011.
-
Dommergues M et al. Report of the French Comité national technique de l'échographie de dépistage prénatal (prenatal ultrasound): what are the practical consequences?. Gynécologie Obstétrique & Fertilité. 2006
-
Committee opinion. Placenta Accreta. Am J Obstet Gynecol. 2012
-
Miller DA, Chollet JA, Goodwin TM. Clinical risk factors for placenta previa-placenta accreta. Am J Obstet Gynecol. 1997 Jul;177(1):210-4.
-
Bowman ZS et al. Accuracy of ultrasound for the prediction of placenta accreta. Am J Obstet Gynecol. 2014.
-
Comstock CH et al. The antenatal diagnosis of placenta accreta. BJOG 2014.
-
Stirnemann J et al. First-trimester uterine scar assessment by transvaginal ultrasound. Am J Obstet Gynecol. 2011
-
Stirnemann J et al. Screening for placenta accreta at 11-14 weeks of gestation. Am J Obstet Gynecol. 2011



