Cet article a pour objectif de simplifier et homogénéiser la conduite à tenir en cas de fœtus présentant une microcéphalie de découverte fortuite à l’échographie.
La difficulté de la prise en charge réside sur le fait qu’il n’existe pas, à ce jour, de définition précise de la microcéphalie en anténatal. En effet, il existe d’une part, plusieurs manières d’exprimer des biométries (Percentile, Zscore, déviation standard, multiple de la médiane) et d’autre part, différents seuils en fonction de la sensibilité, spécificité souhaités par les équipes (5ème Percentile, 3ème Percentile, -2 Zscore, -3 Zscore). Le pronostic neuro-développemental avec le risque de retard mental est clairement corrélé au degré de gravité de la microcéphalie. En effet, en cas de périmètre céphalique entre -3 Zscore et -4 Zscore, le risque de retard mental est d’environ 50 % et de 100% en cas de Zscore inférieur à -4 (1).
En réalisant une synthèse de l’ensemble des données de la littérature, il paraît plus simple et plus précis d’utiliser les déviations standards (DS) ou les Zscores pour caractériser la microcéphalie.
Incidence
Sans définition précise de la microcéphalie, l’incidence de cette anomalie biométrique est difficile à déterminer. En effet, en fonction du seuil utilisé, l’incidence varie. En prenant la définition de la microcéphalie « vrai » qui correspond à un périmètre céphalique inférieur à -3DS (ou -3 Zscore), l’incidence est d’environ 1/10 000 (2)
Rappel sur les Zscore – Déviation standard – Percentile (Figure 1)
- Percentile : Méthode la plus utilisée actuellement.
Elle permet de savoir quel pourcentage de la population à une valeur inferieure à celle mesurée. Le problème, de cette méthode, est l’approximation pour les mesures extrêmes (< 3ème percentile)
- Zscore et Déviation standard : Exprime l’écart par rapport à la valeur moyenne.
Il s’agit de la méthode recommandée par l’OMS avec une équivalence entre Zscore et DS. En effet, -2DS équivaut à -2Zscore. Ceci permet de calculer les percentiles avec précision.
En cas de microcéphalie de découverte fortuite à l’échographie de dépistage, il convient de vérifier systématiquement 2 conditions préalables :
- Erreur de la datation de la grossesse : Faux positif
En cas de microcéphalie fœtale, il est recommander de contrôler systématique si l’on est confronté à une erreur de datation du terme de la grossesse.
Dans ce cas de figure, vérifier la mesure de la longueur cranio-caudale lors de l’échographie de datation ou de l’échographie du 1er trimestre.
- Technique de mesure du périmètre céphalique (3, 4)
Standard biométrique établi par le collège Français d’Echographie Fœtal (CFEF) et l’INSERM
La mesure du périmètre céphalique doit être rigoureuse et la coupe du pôle céphalique doit répondre à des critères de qualités bien précis (Figure 2).
Le plan de mesure doit être symétrique sur une coupe axiale du pôle céphalique.
Le plan passe par les thalami, la cavité du septum pellucidum et dans la partie postérieure, le cervelet ne doit pas être visible.
La taille de l’image doit être supérieur à la moitié de l’image échographique.
Les calipers doivent être correctement placés au milieu des tables osseuses proximale et distale.
Classification des microcéphalies (Figure 3)
La microcéphalie fœtale peut être classée en 2 catégories :
Primaire (isolé) / Secondaire (génétique et environnemental) (5)
Le pronostic fœtal est essentiellement déterminé par le caractère isolé ou non de la microcéphalie (6).
Conduite à tenir en pratique
En cas de microcéphalie de découverte fortuite à l’échographie de dépistage, il est habituellement recommandé de vérifier les différents points suivants :
- Vérifier la datation de la grossesse (Echographie de datation, Echographie du 1er trimestre).
- Vérifier la qualité de la mesure du périmètre céphalique (technique de mesure).
- Eliminer systématique une anomalie de fermeture du tube neural (AFTN):
En effet, en cas d’AFTN, la microcéphalie est un des signes indirects avec la malformation de Chiari II au niveau de la fosse postérieur et la déformation du crâne en « citron » (7). En cas de doute, l’analyse du rachis doit être minutieuse à la recherche d’un défect osseux rachidien.
- Vérifier les sérologies maternelles en insistant sur la sérologie cytomégalovirus (CMV) (8).
- Appréciation d’un contexte de retard de croissance intra utérin d’origine vasculaire (Fémur court, estimation du poids fœtale, Doppler utérin, liquide amniotique, placenta).
- Réaliser une échographie de référence de seconde intention pour rechercher des signes associés à la microcéphalie. Le principal objectif est de rechercher des signes échographiques cérébraux (malformation cérébrale, ventriculomégalie, désorganisation architecturale cérébrale, trouble de la gyration) et extra-cérébraux (malformation du coeur, face, extrémités, thorax, abdomen, organes génitaux externes, liquide amniotique).
En fonction de l’analyse échographique et du terme de la grossesse, il sera discuté de l’indication d’une IRM fœtale vers 32SA afin d’affiner l’analyse anatomique cérébrale et éliminer une malformation cérébrale non visualisable en échographie.
- Bilan génétique
En fonction du contexte, une consultation spécialisée anténatale dans un centre pluridisciplinaire de diagnostic prénatal (CPDPN) est à organiser afin de discuter et proposer une amniocentèse (caryotype, analyse chromosomique sur puce à ADN (ACPA), micro-délétion). Une consultation génétique de synthèse avec enquête familiale peut, également, être proposée au couple en fonction des différents résultats.
Microcéphalie fœtale nécessitant une analyse spécifique :
1- Microcéphalie et hypotrophie cérébrale (Figure 4)
En cas de microcéphalie sévère < -3DS ou <-3ZScore, l’analyse du cortex cérébral est fondamental. En effet, il convient de rechercher une hypotrophie cérébrale associée et des troubles de la gyration. L’échographie peut suspecter ces anomalies en analysant la vallée sylvienne et les différents sillons du cerveaux (lissencéphalies, troubles de la migrations à type d’hétérotopies, polymicrogyries). Dans ce contexte, une IRM fœtale sera indiquée vers 32SA afin d’améliorer l’analyse anatomique de l’architecture cérébrale.
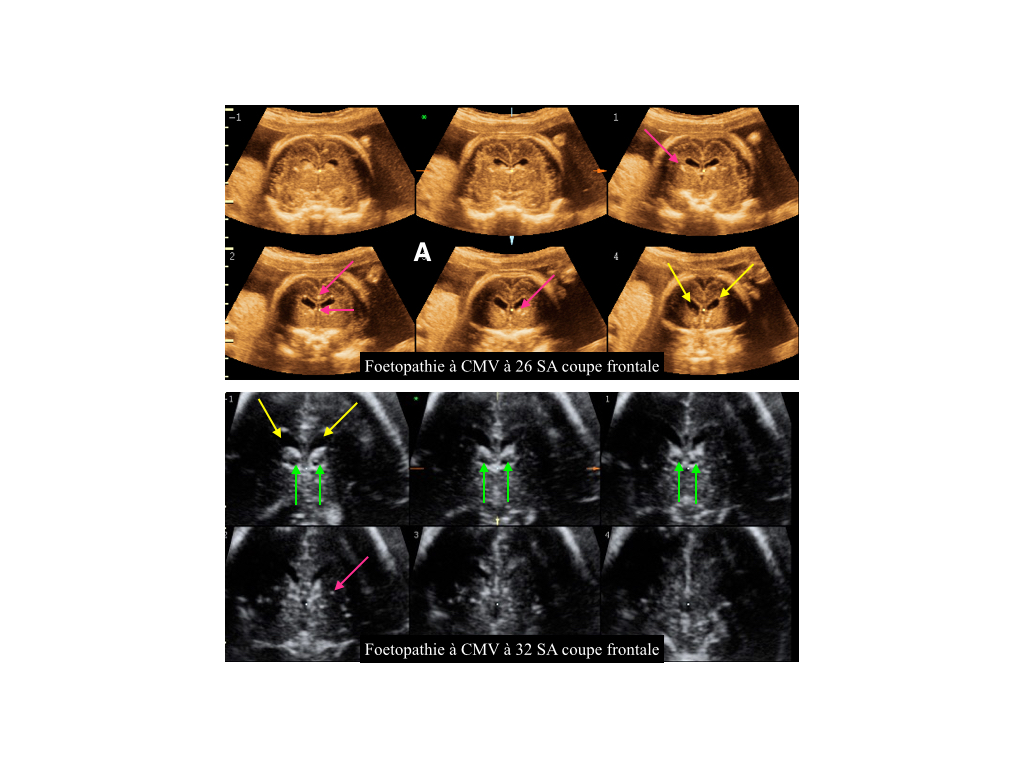
2- Microcéphalie et CMV (Figure 5)
Les signes échographiques peuvent êtres plus ou moins difficiles à visualiser en échographie. Une analyse fine de l’ensemble des structures cérébrales peut permettre la mise en évidence d’une ventriculomégalie limite (mesure du ventricule postérieur entre 10 et 12 mm), des signes échographiques de micro-encéphalie avec des espaces péri-cérébraux élargis, troubles de la gyration, échogénicité péri-ventriculaire avec halo péri-ventriculaire et pseudo-kystes péri-ventriculaires (phénomène de nécrose et cavitation parenchymateuse) (8).
3- Microcéphalie et anomalie des organes génitaux externes (OGE)
En cas de microcéphalie, la recherche d’une malformation échographique des OGE peut faire suspecter le syndrome de Smith-Lemli-Opitz (SLO). Ce syndrome présente une incidence d’environ 1/30 000 naissances et est responsable d’un déficit intellectuel fréquent (9). La microcéphalie est diagnostiquée en anténatal dans 80% des cas avec des anomalie des OGE dans environ 70%. La transmission est autosomique récessive et l’on retrouve une mutation du gène DHCR7 responsable d’un déficit en 7-déhydrocholestérol réductase. L’amniocentèse permet de mettre en évidence cette anomalie et ainsi confirmer le diagnostic (9).
4- Microcéphalie et extrémités fœtales
Le syndrome de Cornelia de Lange est un syndrome malformatif d’expression variable dont l’incidence est d’environ 1/50 000. Le diagnostic est difficile en anténatal et repose essentiellement sur un retard de croissance intra-utérin associé à une microcéphalie et des anomalies des extrémités à type d’oligodactylie, amputation et hypoplasie du 1er métacarpien (signe pathognomonique) (10). La coupe sagittale échographique de la face fœtale peut permettre d’identifier dans certains cas une dysmorphie caractéristique (rétrognathisme) (10)
Pronostic
Le pronostic le plus difficile à évaluer, en anténatal, est la microcéphalie isolée (11).
En effet, en cas de microcéphalie associée à d’autres anomalies échographiques le pronostic neuro-développemental est le plus souvent sombre avec la nécessité d’une prise en charge multidisciplinaire (neuro-pédiatrie, génétique) (6).
Le risque de retard mental chez les enfants qui présent une microcéphalie entre -2DS et -3DS est de 10,5%. 51,2% en cas de microcéphalie entre -3DS et -4DS et environ 100% de retard mental en cas de périmètre céphalique inférieur à - 4DS. (1)
Selon kurtz et al (12), les fœtus qui présentent un périmètre céphalique fœtale entre -2 et -3DS isolé ont une forte probabilité d’avoir un développement neurologique sans particularité.
Les issues neuro-développementales sont de bon pronostic lorsque la microcéphalie est isolée et située entre -2DS et -3DS avec une forte probabilité de mesurer des biométries céphaliques postnatales dans la normale. Il est, alors, possible de rassurer les couples sur le pronostic neurologique post-natal. C’est pour cela qu’ils suggèrent de retenir la définition de microcéphalie lorsque le périmètre céphalique est inférieur à -3DS. En effet dans cette situation, le pronostic neuro-développemental post natal est incertain et un bilan fœtal complet doit être proposé au couple afin d’offrir une information pluridisciplinaire la plus adaptée à la situation.
Conclusion
La découverte d’une microcéphalie en anténatal nécessite une prise en charge particulière et adaptée afin de répondre de façon claire et précises aux couples. Confirmer le diagnostic de microcéphalie « vraie » inférieure à -3Zscore (ou -3DS) puis vérifier son caractère isolé ou non sont les deux éléments pronostics les plus significatifs.
Le couple doit être orienté vers une consultation spécialisée de diagnostic anténatal dont l’objectif sera de déterminer le pronostic et le mode de suivi de cette anomalie biométrique. En fonction des différents résultats, il sera discuté de l’indication d’une amniocentèse, d’une IRM fœtale et d’une consultation génétique afin d’affiner l’analyse de la microcéphalie fœtale.
Bibliographie
(1) Dolk H. The predictive value of microcephaly during the first year of life for mental retardation at seven years. Dev Med Child Neurol 1991; 33: 974–983.
(2) Goodman RM, Gorlin RJ. The malformed infant and child: an illustrated guide. New York: Oxford University Press, 1983:432.p72)
(3) Créquat J, Duyme M, Brodaty G. Biometry 2000. Fetal growth charts by the French College of fetal ultrasonography and the Inserm U 155 Gynecol Obstet Fertil. 2000 Jun;28(6):435-45.
(4) Salomon LJ, Duyme M, Crequat J, Brodaty G,Talmant C, Fries N, Althuser M. French fetal biometry: reference equations and comparison with other charts. Ultrasound Obstet Gynecol. 2006 Aug;28(2):193-8
(5) Abuelo D. Microcephaly Syndromes, Seminars in Pediatric Neurology, Volume 14, Issue 3, September 2007, Pages 118–127
(6) Kurmanavicius J, Wright EM, Royston P, Wisser J, Huch R, Huch A, Zimmermann R. Fetal ultrasound biometry: 1.Head reference values. Br J Obstet Gynaecol 1999; 106.
(7) Nicolaides KH, Campbell S, Gabbe SG, Guidetti R. Ultrasound screening for spina bifida: cranial and cerebellar signs. Lancet. 1986 Jul 12;2(8498):72-4.
(8) Jacquemard F, Yamamoto M, Costa JM, Romand S, Jaqz-Aigrain E, Dejean A, Daffos F, Ville Y. Maternal administration of valaciclovir in symptomatic intrauterine cytomegalovirus infection. BJOG. 2007 Sep;114(9):1113-21. Epub 2007 Jul 6.
(9) Haas D, Haege G, Hoffmann GF, Burgard P. Prenatal presentation and diagnostic evaluation of suspected Smith-Lemli-Opitz (RSH) syndrome. Am J Med Genet A. 2013 May;161A(5):1008-11.
(10) Mikołajewska E1. Interdisciplinary therapy in Cornelia de Lange syndrome - review of the literature. Adv Clin Exp Med. 2013 Jul-Aug;22(4):571-7.
(11) Bromley B, Benacerraf BR. Difficulties in the prenatal diagnosis of microcephaly. J Ultrasound Med 1995; 14: 303–305.
(12) Kurtz AB, Wapner RJ, Rubin CS, Cole-Beuglet C, Ross RD, Goldberg BB. Ultrasound criteria for in utero diagnosis of microcephaly. J Clin Ultrasound 1980; 8: 11–16.
Tableau figure
Figure 1 : Courbe de Gauss
.jpg)
Figure 2 : Critères de qualités pour la mesure du périmètre céphalique
.jpg)
Figure 3 : Classification des microcéphalies
Causes génétique et environnementale selon Abuelo D et al. Microcephaly Syndromes, ,Seminars in Pediatric Neurology, 2007.
.jpg)
Figure 4 : Image échographique – Coupe frontale du cerveau à 26 semaines d’aménorrhées.
Hypotrophie cérébrale avec augmentation des espaces péri-cérébraux et disparition des circonvolutions cérébrales habituelles.
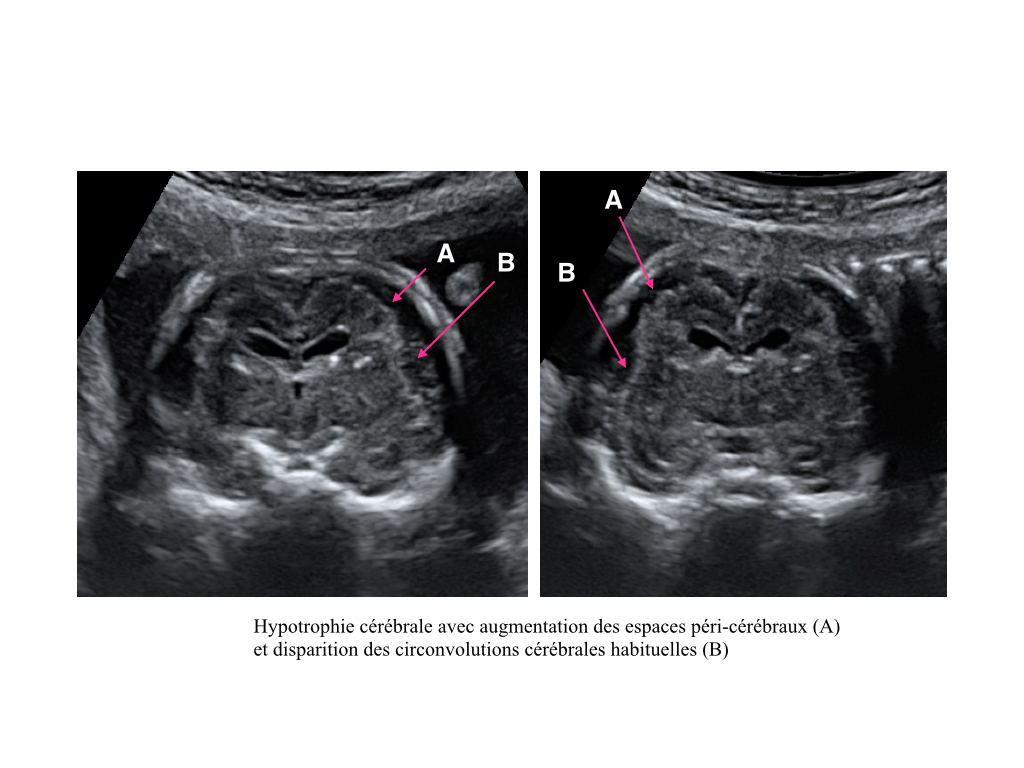
Figure 5 : Coupes échographiques frontales en mode volumique (TUI) dans un contexte de foetopathie à cytomégalovirus (CMV) à 26 et 32 semaines d’aménorrhées (SA).
Visualisation d’hyperéchogénicités fines disséminées dans l’ensemble du cortex cérébral (flèches roses). Présence d’une dilatation modérée des cornes ventriculaires antérieures cérébrales (flèches jaunes). Présence de pseudo-kystes péri-ventriculaires (flèches vertes).