La méthylation est un processus biochimique ubiquitaire, fortement impliqué dans l’épigénèse, l’empreinte et d’une façon plus générale dans la stabilité du génome et la régulation de l’expression génique. En reproduction, elle est très impliquée dans la qualité des gamètes, et dans la croissance embryonnaire dès les stades préimplantatoires, la formation du blastocyste et au delà. Ce processus est très dépendant des cycles de la méthionine et des folates [voir figure]. Ces deux cycles, à l’origine de la vie, sont soumis à des mutations, les plus souvent il s’agit de polymorphismes touchant une base « single nucléotide polymorphisme : SNP ». Les plus connues et prégnantes concernent, dans le cycle des folates, le gène MTHFR (méthylène tétrahydrofolate réductase). Ce gène produit une protéine qui catalyse la formation de 5MTHF (5Methyltetrahydrofolate), composé actif qui permet la régénération de l’homocystéine (Hcy) en méthionine (Met). La méthionine est le cofacteur de toute les méthylations et l’Hcy après méthylation des molécules cibles est libérée. Mais l’Hcy est un poison cellulaire universel [1] et doit être impérativement éliminée, notamment via son recyclage en Méthionine (Figure 1) ;
Les 2 principales, plus fréquentes, prévalentes et handicapantes, isoformes de la MTHFR sont la C677T et la A1298C. En présence de ces isoformes liées à la mutation du gène MTHFR, la génération de folate actif (5MTHF) peut être réduite de 75% et provoquer une montée d’Homocystéine, pouvant être réduite par un apport exogène de 5MTHF [2-3], le 5 MethylTHF étant nécessaire pour le recyclage de l’homocystéine en méthionine.
Bien que certaines sociétés « savantes » semblent réfuter l’importance des mutations du gène MTHFR en fertilité (dont les échecs multiples de FIV) et notamment dans le cas de fausses couches à répétition, de plus en plus de travaux indiquent au contraire leur importance incontournable.
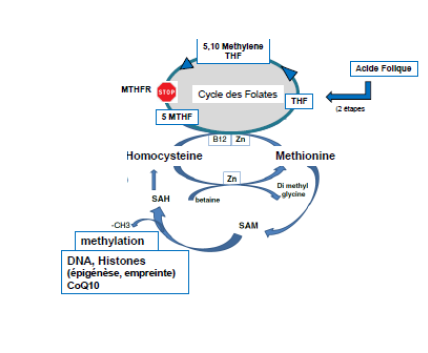
Figure1 Recyclage de l’homocysteine et cycle des folates. Les isoformes de la -MTHFR (Methylne TetraHydroFolate Reductase) affectent négativement le recyclage de l’homocysteine et ainsi altèrent le processus de méthylation, donc l’empreinte et l’épigénèse
1 - Les travaux de ENCISO et al. 2016 [4] « Polymorphisms in the MTHFR gene influence embryo viability and the incidence of Aneuploidy”. Ces auteurs ont étudié, sur l’embryon humain, par PGT-A (preimplantation génétique screening pour aneuploïdie) l’influence des deux isoformes C677T et A1298C sur “qualité chromosomique” embryonnaire. Les résultats sont « sans appel » :
*Un taux significativement plus élevé d’aneuploidie est observé dès que les patients présentent un allèle muté. (MTHFR 677T et/ou MTHFR 1298C) comparé au patient qui n’en portent aucun. (p = 0.038)
*La présence d’une hétérozygotie C677T embryonnaire diminue la normalité chromosomique d’un tiers. De plus, l’homozygotie T677T la diminue de 90%.
![Risque d’échec d’implantation et génotype embryonnaire (C677T). En vert taux d’implantation, rouge taux d’échec par embryon d’après Enciso et al.[4])](/sites/default/files/inline-images/2.png)
Figure 2 : Risque d’échec d’implantation et génotype embryonnaire (C677T). En vert taux d’implantation, rouge taux d’échec par embryon d’après Enciso et al.[4])
*Ces résultats sur le génome embryonnaire indiquent de facto l’importance de l’effet paternel
2 - Les travaux chez l’animal de Ishitani et al (2020) [5] « Embryonic MTHFR contributes to blastocyst development » : Ces auteurs ont réalisé l’étude sur des embryons de bovins, qui sont un meilleur modèle expérimental pour l’humain que l’embryon de souris, notamment du fait des cinétiques de développement. Dans un premier temps, ils observent que le gène MTHFR est fortement exprimé dans l’ovocyte. Son intensité décroit jusqu’au stade 8-16 cellules puis recommence à croitre au stade blastocyste. Ce type de scénario est classique du développement embryonnaire pré-implantatoire. En effet pendant ce temps, l’embryon se développe sur les réserves ovocytaires accumulées pendant la croissance de l’ovocyte et ceci jusqu’u stade de l’activation génomique (4-8 cellules chez l’humain, 72 heures post fécondation). A ce stade commencent les transcriptions des génomes paternels et maternels.
Les auteurs ont « knock-outé » (désactivé), par la technique du SiRNA (Small interférence ARN), le gène MTHFR dans les embryons au stade 8-6 cellule qui correspond au cycle d’activation génomique. Ils ont alors étudié la formation de blastocystes. Ils montrent tout d’abord que le système de « knock out » est efficace : une réduction de 74% de l’expression MTHFR (p<0.05) est observée par rapport au control. L’expression de la protéine est divisée par deux (p<0.01) par rapport au control.
- La formation de blastocyste est divisée par deux : p<0.01
- le nombre de cellules total par blastocyste chute de plus de 40% : p<0.0001
- Le nombre de cellules du trophectoderme chute de 30% : p<0.0001
- Le nombre de cellules de la masse cellulaire interne est également divisé par deux : p<0.001
Toutes ces différences sont significatives.
On observe donc que la qualité des blastocystes résiduels formés est dégradée, ce qui implique, si l’on s’en tient au trophoblaste, des risques accrus de perte embryonnaire. Il y a à ce niveau une conjugaison d’effets paternels (trophoblastes) et maternels (masse cellulaire interne)
![Impact de l’extinction de la MTHFR sur la formation de blastocyste (d'après Ishitani et al.[5] ).](/sites/default/files/inline-images/3.png)
Impact de l’extinction de la MTHFR sur la formation de blastocyste (d'après Ishitani et al.[5] ). Figure 3
3 - Impact des effets paternels : Yang Yu, et al.[6] Hyperhomocysteinemia in men with a reproductive history of fetal neural tube defects, Three case reports and literature review; Ces auteurs décrivent 3 cas de patients homozygotes 677TT avec montée d’homocysteine. Meningocele, spina bifida, hydrocephalus, anencephalie, et cheilopalatognathus ont été observés chez les fœtus. Dans ces 3 cas une femme était indemne de mutation et deux étaient C677T.
Nous avons pu observer des fausses couches à répétition et des échecs de FIV répétés pour des couples présentant les mêmes profils génétiques [2]. Par ailleurs, chez un couple ayant subi 6 échecs de FIV et 3 échecs de don d’ovocytes, sous acide folique pour la femme qui est hétérozygote C667T ; la détermination des isoformes chez le mari a montré une homozygotie 677TT sans montée d’homocystéine. 8 semaines après traitement du mari avec le 5MTHF, composé en aval du blocage MTHFR, une grossesse spontanée a démarré. Elle s’est poursuivie à terme avec naissance d’une petite fille à 38 semaines d’un poids de 2.7 Kg et d’une taille de 49centimetres [7]
Ces observations sont complètement en ligne avec les publications qui décrivent l’effet pénalisant des isoformes MTHFR sur la spermatogénèse et l’impact délétère des traitements à l’acide folique forte dose, qui, chez ces porteurs perturbent totalement le methylome spermatique [8-9]
Conclusion: Les auteurs de la publication de Enciso indiquent : “a significant aneuploidy rate was found in those patients presenting at last one minor MTHFR allele (677T and/or MTHFR 1298C) compared to those patients with none (p<.0038)”. Dès que les patients sont porteurs d’une des deux isoformes, le risque de problème épigénétique et chromosomique apparait. Il se répercutera bien sur la formation de blastocystes et au delà sur la qualité de l’implantation embryonaire. Ceci conduira donc à des retards dans l’obtention de grossesse (pertes embryonnaires ou fœtales). Il est curieux que les sociétés « savantes » peinent à intégrer ces observations. D’autant que 1- la prévalence de ces isoformes est forte ; 2- ces isoformes affectent également la qualité du sperme ; 3- les perturbateurs endocriniens aggravent les problèmes de méthylation/empreinte/epigénèse [10]
Il est évident que la détermination de ces isoformes n’est pas une analyse de première intention, mais elle ne doit pas être négligée en cas d’échecs récurrents et elle doit impliquer les deux membres du couple. Enfin les traitements à base de 5MTHF existent et sont efficaces alors que les traitements à base d’acide folique haute doses ne le sont que peu. Avec de plus un risque associé de UMFA ; augmentation d’acide folique non métabolisé dans le sang, source d’autres problèmes de santé. En plus de la recherche des mutation MTHFR, le dosage de l’homocysteine peut être conseillé en présence chez les porteurs de l’isoforme 677T et chez les hétérozygotes composites 677T/1298C afin d’évaluer l’impact de ces isoformes.
1-Škovierová H, Vidomanová E, Mahmood S, Sopková J, Drgová A.Červeňová T, Halašová E, Lehotský J. The Molecular and Cellular Effect of Homocysteine Metabolism Imbalance on Human Health. Int J Mol Sci. 2016; 17. pii: E1733
2-Servy EJ, Jacquesson-Fournols L, Cohen M, Menezo YJR. MTHFR isoform carriers. 5--MTHF (5-methyl tetrahydrofolate) vs folic acid: a key to pregnancy outcome: a case series.J Assist Reprod Genet. 2018 ;35:1431-1435.
3-The Methylene Tetrahydrofolate Reductase (MTHFR ) isoform Challenge. High doses of folic acic are not a suitable option compared to 5 MethyltetrHydrofolate treatment. Clin Obstet Gynecol reprod med 2017: 3:1-5
4- Enciso M, Sarasa J, Xanthopoulou L, Bristow S, Bowles M, Fragouli E, Delhanty J, Wells D. Polymorphisms in the MTHFR gene influence embryo viability and the incidence of aneuploidy. Hum Genet. 2016;135:555-68.
5-Ishitani H, Ikeda S, Egashira K, Sugimoto M, Kume S, Minami N, Ohta T Embryonic MTHFR contributes to blastocyst development..J Assist Reprod Genet. 2020, 37:1807-1814
6- Yu Y, Jia C, Shi Q, Zhu Y, Liu Y Hyperhomocysteinemia in men with a reproductive history of fetal neural tube defects: Three case reports and literature review. Medicine (Baltimore). 2019;98:e13998.
7-Jacquesson-Fournols L, Alvarez S, Cohen M, Clement P, Menezo Y.J A paternal effect of MTHFR SNPs on gametes and embryos should not be overlooked: case reports. J Assist Reprod Genet. 2019 ;36:1351-1353.
8-M. Aarabi, M.C. San Gabriel, D. Chan, N.A. Behan, M. Caron, T. Pastinen, et al., High-dose folic acid supplementation alters the human sperm methylome and is influenced by the MTHFR C677T polymorphism, Hum Mol Genet 2015; 25: 6301–6313.
9-M. Aarabi, K.E. Christensen, D. Chan, D. Leclerc, M. Landry, et al., Testicular MTHFR deficiency may explain sperm DNA hypomethylation associated with high dose folic acid supplementation, Hum Mol Genet 2018; 27: 1123–1135.
10- Menezo YJ, Silvestris E, Dale B, Elder K. Oxidative stress and alterations in DNA methylation: two sides of the same coin in reproduction. Reprod Biomed Online. 2016; 33:668-83



