Introduction
Avec près de 58 000 nouveaux cas par an, le cancer du sein est le cancer le plus fréquent en France. L'incidence du cancer du sein est actuellement globalement stable, après avoir doublé entre 1985 et 2005. Mais si l'incidence du cancer du sein diminue chez les femmes de 50 à 79 ans qui bénéficient du programme national de dépistage du cancer du sein, elle augmente de plus de 60 % pour les femmes de 30 à 49 ans. Avec 12 000 décès par an (estimés en 2017), la mortalité par cancer du sein diminue en France et le cancer du sein est l'un des cancers de meilleur pronostic avec des taux de survie à cinq et dix ans de 87 % et 76 %, respectivement[1]. Pourtant, la prise en charge des patientes atteintes d’un cancer du sein reste un défi thérapeutique, en particulier pour les cancers du sein triple négatif et les cancers du sein HER2+, pour lesquels des améliorations sont à la fois possibles et nécessaires [1].
Dans de nombreux pays, l’organisation de réunions de concertation pluridisciplinaire (RCP) a été introduite afin de promouvoir la décision collective des différents professionnels de santé impliqués dans la prise en charge des patients atteints de cancer. En France, les RCP, promues depuis le Premier Plan Cancer 2003 – 2007[2], figurent parmi les obligations réglementaires pour les établissements autorisés à prendre en charge les patients atteints de cancer. Si des études ont montré que les RCP permettaient d’améliorer la conformité des décisions aux guides de bonnes pratiques [2], le bon fonctionnement des RCP est souvent entravé par le manque de temps, la quantité d’informations à gérer, et la complexité des cas discutés. Ainsi, l’impact des RCP sur la qualité des soins a été remis en cause [3].
Les systèmes d’aide à la décision médicale (SADM) sont des outils informatiques mettant en œuvre des algorithmes qui permettent l’analyse automatique des caractéristiques d’un patient afin de produire des propositions personnalisées de prise en charge diagnostique, thérapeutique, ou de suivi. Ces algorithmes issus de l’intelligence artificielle (IA) utilisent des approches numériques qui se fondent sur un apprentissage à partir de données, ou des approches symboliques qui utilisent des connaissances, en particulier celles issues des guides de bonnes pratiques, et reproduisent les raisonnements de l’expert humain engagé dans sa démarche décisionnelle (inférences). Les SADM ont fait la preuve de leur potentiel à améliorer les décisions médicales à toutes les étapes du parcours de soins [4].
Aide à la décision pour la prévention et le dépistage du cancer du sein
Selon le Centre international de Recherche sur le Cancer, 41 % des cancers seraient « évitables ». Éviter les facteurs de risque connus apparaît ainsi comme un moyen d’action essentiel pour prévenir certains cancers. Pour aider chacun à adopter des stratégies de prévention utiles, l’institut national du cancer propose un test en ligne « Prévention cancers : le test, 3 minutes pour faire le point »[3]. Ce test se présente sous la forme d’un questionnaire sur la consommation de tabac et d’alcool, les habitudes alimentaires et d’activité physique, l’exposition au soleil, l’âge et le poids mais aussi les risques liés au milieu professionnel. Il permet à chacun de connaître les facteurs de risque auxquels il est exposé à travers son mode de vie et donne des conseils sur mesure pour les diminuer. C’est un premier exemple « macroscopique » d’aide à la décision en oncologie, destiné ici aux patients.
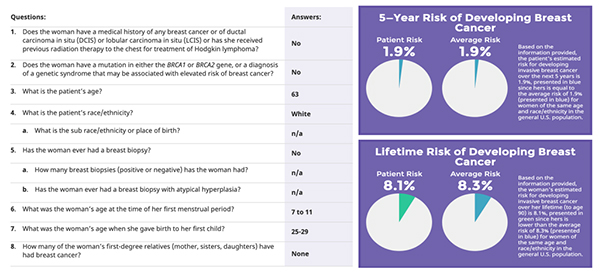
Plus précisément, il existe des outils de calcul du risque personnalisé de cancer du sein [5]. Le plus ancien, le score de Gail [6], développé par le National Cancer Institute et validé sur une population de femmes américaines, est basé sur un modèle statistique ne prenant en compte que des facteurs de risque individuels[4] (cf. figure 1). Plus récemment le modèle IBIS, développé par Tyrer et al. [7] a l’avantage d’une relative exhaustivité puisqu’il tient compte, d’une part, des facteurs de risque individuels, mais également des facteurs de risque familiaux[5].
Figure 1 : Calcul du risque de cancer du sein selon le modèle de Gail, pour une femme de 63 ans sans antécédent personnel ni familiaux, ayant eu ses premières règles entre 7 et 11 ans et son premier enfant entre 25 et 29 ans.
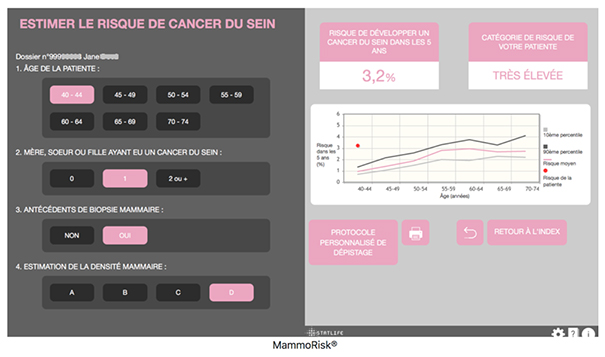
Le modèle Mammorisk[6] se base sur l’évaluation, à partir d’une base de données, des risques de cancer du sein d’une femme, par comparaison au devenir de ses « plus proches voisines » (mise en œuvre de méthodes statistiques et de fouille de données ou data mining) pour évaluer son risque de développer un cancer du sein. Le modèle intègre cinq facteurs : l’âge, la densité mammaire quantifiée à partir la mammographie, le nombre d’apparentées au 1er degré atteintes d’un cancer du sein (mère, sœur, fille), l’existence d’un antécédent ou non de biopsie mammaire et un score polygénique, quand il est disponible (cf. figure 2). Cet outil développé sur une population de femmes américaines et validé sur une population de femmes françaises est utilisé dans certains cabinets de radiologie et dans la plateforme de gestion des risques en cancérologie de l’hôpital de la Pitié-Salpétrière[7] pour informer les femmes sur leur risque personnalisé de cancer du sein et les orienter dans leur choix des modalités de dépistage appropriées. Cet outil est d’ailleurs utilisé dans le programme européen MyPeBS[8] dont l’objectif est de comparer le dépistage personnalisé basé sur le risque au dépistage standard afin d’évaluer si un dépistage personnalisé basé sur le risque pourrait être une meilleure option de dépistage pour les femmes de 40 à 70 ans.
Figure 2 : Selon le modèle MammoRisk, le risque de développer un cancer du sein dans les 5 ans chez une femme de 40-44 ans, avec un antécédent familial de 1er degré, un antécédent personnel de biopsie mammaire, et une densité mammaire classée D est de 3,2%, très supérieur au risque moyen pour les femmes du même âge.
Il existe de nombreux autres systèmes de calcul du risque personnalisé de cancer du sein accessibles en ligne à destination du grand public tels que « Mon QICancer » développé par Action Cancer Ontario[9]. Ils sont très pédagogiques (cf. figure 3) mais ils ne précisent pas la nature du modèle scientifique sous-jacent à l’estimation du risque et on ne sait donc pas évaluer s’ils sont scientifiquement valides.
Figure 3 : Le système « Mon QICancer » se présente sous la forme d’un questionnaire explorant les caractéristiques patiente regroupées en chapitres (antécédents personnels, familiaux, génétiques, examens de dépistage et soins médicaux, hygiène de vie, et santé sexuelle). Les résultats donnent la valeur du risque personnalisé par rapport à la moyenne et décrivent les principaux facteurs de risque et facteurs protecteurs.
Aide à la décision pour le diagnostic du cancer du sein
Pour ce qui concerne l’aide au diagnostic, de nombreux travaux ont été publiés depuis le début des années 2010 sur l’utilisation d’algorithmes d’apprentissage automatique, dont l’apprentissage profond ou deep learning, avec la mise en œuvre de réseaux de neurones numériques entraînés sur un ensemble d’exemples annotés, par exemple un ensemble de mammographies pour lesquelles le diagnostic de cancer du sein, ou d’absence de cancer du sein est indiqué. Par la suite, la mise en œuvre des réseaux neuronaux convolutionnels (CNN) a révolutionné le domaine de la vision par ordinateur (reconnaissance faciale, voiture autonome, biométrie, etc.) et a permis le développement de systèmes d’aide au diagnostic avec d’excellentes performances dans la détection de masses tumorales à partir des mammographies [8]. L’analyse des images passe par une étape de segmentation permettant au système de détecter les régions d’intérêt, suivie d’une étape d’analyse de la structure du tissu mammaire au sein de ces régions d’intérêt pour détecter les masses tumorales.
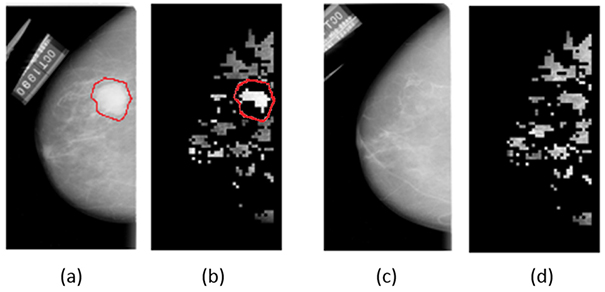
Récemment, une méthode prenant en compte l’analyse des mammographies bilatérales, permettant ainsi de comparer la structure du tissu mammaire au niveau des deux seins (cf. figure 4) et de détecter les asymétries a été proposée avec une précision de plus de 90 % de bons diagnostics [9].
Figure 4 : (a) sein gauche avec une tumeur, (b) image du sein gauche segmentée, (c) sein droit, (d) image du sein droit segmentée pour comparaison des images segmentées et identification de la lésion à gauche (image extraite de [9]).
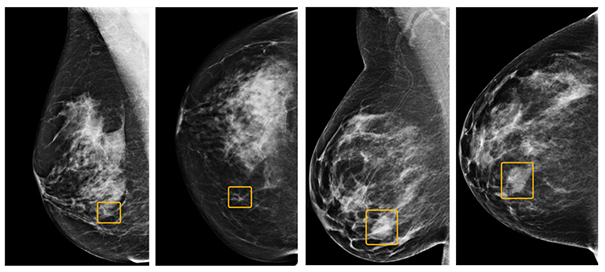
Encore plus récemment, une IA développée par Google s’est montrée meilleure que des experts humains pour la détection de cancers du sein à partir de mammographies en diminuant de façon significative les faux positifs et les faux négatifs [10]. On notera toutefois que bien que le système ait surpassé les médecins dans la plupart des cas, il y a eu des cas où les médecins détectaient un cancer du sein qui n'était pas détecté par l’IA (cf. figure 5).
Figure 5 : Sur les deux images de gauche, un exemple de cancer du sein détecté par aucun des experts humains mais identifié par l’IA. La lésion encadrée en jaune est une petite masse irrégulière associée à des microcalcifications, localisée dans le quadrant inféro-interne du sein droit. Sur les deux images de droite, un exemple de cancer détecté par les experts humains, mais raté par l’IA. Dans ce cas, la tumeur est une masse dense localisée dans le quadrant inféro-interne du sein droit. Les images sont extraites de [10].
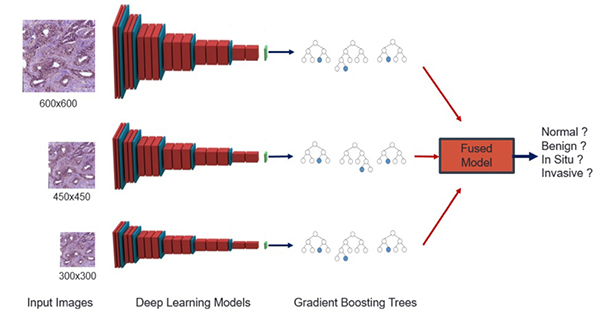
Les méthodes d’IA donnent également de bons résultats pour l’analyse de lames virtuelles d’anatomopathologie. Une étude récente propose une séquence de traitement associant une étape de pré-traitement de l’image impliquant une phase de normalisation (soustraction de la moyenne de l’intensité de l’image à chaque pixel de l'image) puis d’augmentation, à la mise en œuvre d’une étape d’apprentissage profond ou deep learning afin d’extraire les caractéristiques essentielles des images (préalablement apprises sur un échantillon d’apprentissage de lames virtuelles annotées) qui sont traitées ensuite par une méthode de classification permettant de poser le diagnostic, lésion bénigne, cancer in situ, cancer invasif, pas de cancer, avec une précision de plus de 98 %, sauf pour l’in situ où la précision est de 89 % (cf. figure 6) [11].
Figure 6 : Architecture globale de la séquence de traitement des données. Le schéma est extrait de [11].
Aide à la décision pour la prise en charge thérapeutique du cancer du sein
Le groupe Roche a lancé un logiciel destiné à optimiser la prise en charge de patients atteints de cancer et de faciliter les prises de décision du personnel soignant. Baptisée Navify Tumor Board, la solution permet de minimiser le temps passé à la collecte d’informations sur le patient, tels que ses antécédents médicaux, les images de radiologie ou les notes médicales figurant dans son dossier, des opérations souvent effectuées manuellement. Actuellement, ce système permet « seulement » de centraliser les informations dispersées dans différents outils digitaux sans véritable aide à la décision thérapeutique.
Des approches d’intelligence artificielle symbolique telles que celles développées avec le système OncoDoc [12] proposent une aide à la décision pour la prise en charge thérapeutique du cancer du sein selon les guides de bonnes pratiques. L’utilisation du système OncoDoc dans les RCP de sénologie de l’hôpital Tenon (AP-HP) a ainsi permis d’améliorer la conformité des décisions de 79,2 % à 93,4 % sur un échantillon de 226 et 241 décisions, respectivement. La base de connaissances du système est construite sous la forme d’un arbre de décision articulé par des nœuds qui correspondent aux critères décisionnels. Les utilisateurs du système naviguent au sein de cette base de connaissance en répondant à des questions permettant de renseigner les caractéristiques de la patiente et obtiennent finalement les protocoles thérapeutiques qui lui sont recommandés.
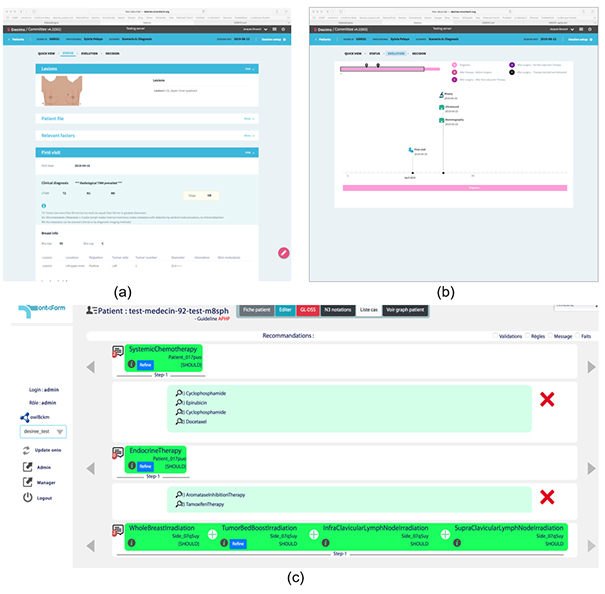
Plus récemment, le projet européen DESIREE[10] propose une aide à la décision multimodale des patientes atteintes de cancer du sein non métastatique avec la proposition de prises en charge (i) issues des recommandations des guides de bonnes pratiques, (ii) apprises par l’expérience à partir de décisions préalables non conformes aux guides de bonnes pratiques mais qui ont été justifiées par la RCP, ou (iii) produites par un raisonnement à partir de cas qui propose le traitement qui avait été décidé pour des patientes similaires. La figure 7a illustre l’interface dossier patient du système DESIREE, la 7b visualise la ligne chronologique des étapes du parcours de soins et la figure 7c propose les recommandations issues des guides de bonnes pratiques.
Figure 7 : Copies d’écran pour l’interface dossier, la ligne des étapes de soins, et les propositions de prise en charge recommandées avec le système DESIREE.
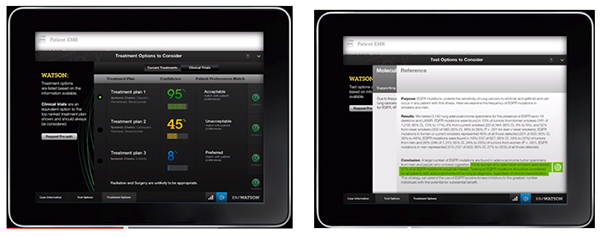
Enfin, le système Watson [13], développé par IBM et entraîné sur des cas résolus de patientes (prises en charge au Memorial Sloan Kettering Cancer Center, New York, USA) utilise des techniques de compréhension du langage naturel et une puissance de calcul considérable pour analyser en temps réel toute la littérature publiée et les informations disponibles sur internet afin de proposer une liste de traitement tenant compte des préférences de la patiente (cf. figure 8).
Figure 8 : Affichage des propositions de prise en charge du système Watson d’IBM (extrait de la vidéo de présentation du système[11])
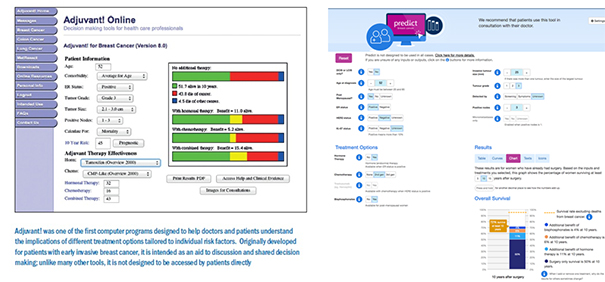
Il existe aussi des algorithmes basés sur les données qui mettent en œuvre des modèles prédictifs pour aider à la décision de prise en charge thérapeutique. Ainsi, le système Adjuvant! Online a longtemps été utilisé en RCP pour évaluer la valeur ajoutée des différents traitements adjuvants. Il s’agissait de renseigner quelques critères dont l’âge de la patiente, son état clinique, les récepteurs hormonaux, la taille de la tumeur, le grade SBR et le nombre de ganglions envahis pour obtenir une estimation des probabilités de survie à 10 ans en fonction du protocole thérapeutique adjuvant administré (chimiothérapie seule, hormonothérapie seule, chimiothérapie et hormonothérapie, aucun traitement).
En cours d’actualisation, Adjuvant! Online n’est plus accessible mais Predict[12] développé par le NHS procède de la même manière (cf. figure 9).
Figure 9 : Probabilités de survie à 10 ans selon le choix du traitement adjuvant avec Adjuvant! Online et Predict.
Conclusion
Dans le cas général de l’oncologie, et en ce qui concerne la prise en charge du cancer du sein, il existe des systèmes d’aide à la décision pour toutes les étapes du parcours de soins. En effet, avec le déploiement des dossiers patients informatisés, et la disponibilité des données de santé dans un format numérique, de nombreux outils d’intelligence artificielle ont été développés dans un objectif d’amélioration de la qualité des soins.
À partir des caractéristiques cliniques, biologiques, d’imagerie, génomiques, etc. des patients, ces systèmes d’aide à la décision proposent les prises en charge personnalisées qui leur sont spécifiquement adaptées. Les systèmes peuvent s’appuyer sur des approches strictement numériques, que ce soit des méthodes d’apprentissage automatique visant à réaliser des opérations de classification, ou la construction de modèles prédictifs pour calculer un risque. Ils peuvent aussi s’appuyer sur des approches symboliques s’appuyant sur une représentation structurée des connaissances d’un domaine, et la mise en œuvre d’un moteur d’inférences capable de raisonner sur les caractéristiques patient à partir des connaissances du domaine. Néanmoins, alors que les approches numériques sont des « boîtes noires » extraordinairement performantes dans l’analyse d’images mais sans aucune capacité explicative, les approches symboliques efficaces dans l’aide à la décision de prise en charge thérapeutique peuvent expliquer l’aide à la décision proposée. L’avenir est sans doute à des systèmes mixtes associant des IA numériques et symboliques pour répondre aux exigences d’une médecine nouvellement qualifiée de 4 P : prédictive, préventive, personnalisée et participative dans un contexte d’exigence sociétale de démocratie sanitaire.
Références
[1] Elsamany S, Abdullah S. Triple-negative breast cancer: future prospects in diagnosis and management. Med Oncol 2014;31(2):834.
[2] Brar SS, Hong NL, Wright FC. (2014). Multidisciplinary cancer care: Does it improve outcomes? J Surg Oncol, vol 110, n° 5, p. 494–499.
[3] Johnson CE, Slavova-Azmanova N, Saunders C. (2017). Development of a peer review framework for cancer multidisciplinary meetings. Intern Med J, vol 47, n° 5, p. 529–535.
[4] Roshanov PS, Fernandes N, Wilczynski JM, Hemens BJ, You JJ, Handler SM, Nieuwlaat R, Souza NM, Beyene J, Van Spall HG, Garg AX, Haynes RB. Features of effective computerised clinical decision support systems: meta-regression of 162 randomised trials. BMJ. 2013;346:f657.
[5] Cohen-Haguenauer O, M. Espie. Les scores de risque du cancer du sein. Réalités en gynécologie-obstétrique, n°141, Novembre/Décembre 2009, p. 8-15.
[6] Gail MH, Brinton LA, Byar DP, Corle DK, Green SB, Shairer C, Mulvihill JJ. Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst 81(24):1879-86, 1989.
[7] Tyrer J, Duffy SW, Cuzick J. A breast cancer prediction model incorporating familial and personal risk factors. Stat Med, 2004 ; 23 : 1 111-30.
[8] Sampaio WB, Diniz EM, Silva AC, de Paiva AC, Gattass M. Detection of masses in mammogram images using CNN, geostatistic functions and SVM. Comput Biol Med. 2011 Aug;41(8):653-64.
[9] Bandeira Diniz JO, Bandeira Diniz PH, Azevedo Valente TL, Silva AC, de Paiva AC, Gattass M. Detection of mass regions in mammograms by bilateral analysis adapted to breast density using similarity indexes and convolutional neural networks. Comput Methods Programs Biomed. 2018 Mar;156:191-207.
[10] McKinney SM, Sieniek M, Godbole V, Godwin J, Antropova N, Ashrafian H, Back T, Chesus M, Corrado GC, Darzi A, Etemadi M, Garcia-Vicente F, Gilbert FJ, Halling-Brown M, Hassabis D, Jansen S, Karthikesalingam A, Kelly CJ, King D, Ledsam JR, Melnick D, Mostofi H, Peng L, Reicher JJ, Romera-Paredes B, Sidebottom R, Suleyman M, Tse D, Young KC, De Fauw J, Shetty S. International evaluation of an AI system for breast cancer screening. Nature. 2020 Jan;577(7788):89-94.
[11] MyVo D, Nguyen NQ, Lee SW. Classification of breast cancer histology images using incremental boosting convolution networks. Information Sciences, vol 482, May 2019, p. 123-138.
[12] Séroussi B, Laouénan C, Gligorov J, Uzan S, Mentré F, Bouaud J. Which breast cancer decisions remain non-compliant with guidelines despite the use of computerised decision support? Br J Cancer. 2013 Sep 3;109(5):1147-56. doi: 10.1038/bjc.2013.453. Epub 2013 Aug 13.
[13] Somashekhar SP, Sepúlveda MJ, Puglielli S, Norden AD, Shortliffe EH, Rohit Kumar C, Rauthan A, Arun Kumar N, Patil P, Rhee K, Ramya Y. Watson for Oncology and breast cancer treatment recommendations: agreement with an expert multidisciplinary tumor board. Ann Oncol. 2018 Feb 1;29(2):418-423.
-----
[1] https://www.e-cancer.fr/ressources/cancers_en_france/ (dernier accès le 10 Janvier 2020)
[2] https://www.e-cancer.fr/Plan-cancer/Les-Plans-cancer-de-2003-a-2013/Le-…
[3] https://www.e-cancer.fr/prevention-cancers-le-test/ (dernier accès le 10 Janvier 2020)
[4] https://bcrisktool.cancer.gov/calculator.html/(dernier accès le 10 Janvier 2020)
[5] https://ibis.ikonopedia.com/(dernier accès le 10 Janvier 2020)
[6] https://predilife.com/home.php/ (dernier accès le 10 Janvier 2020)
[7] https://pgrc.sorbonne-universite.fr/ (dernier accès le 10 Janvier 2020)
[8] https://mypebs.eu/fr/le-projet/ (dernier accès le 10 Janvier 2020)
[9] https://www.mycanceriq.ca/Cancers/Breast (dernier accès le 10 Janvier 2020)
[10] http://desiree-project.eu (dernier accès le 10 Janvier 2020)
[11] https://www.youtube.com/watch?v=w-UCNRUyvI8 (dernier accès le 10 Janvier 2020)
[12] https://breast.predict.nhs.uk/tool (dernier accès le 10 janvier 2020)