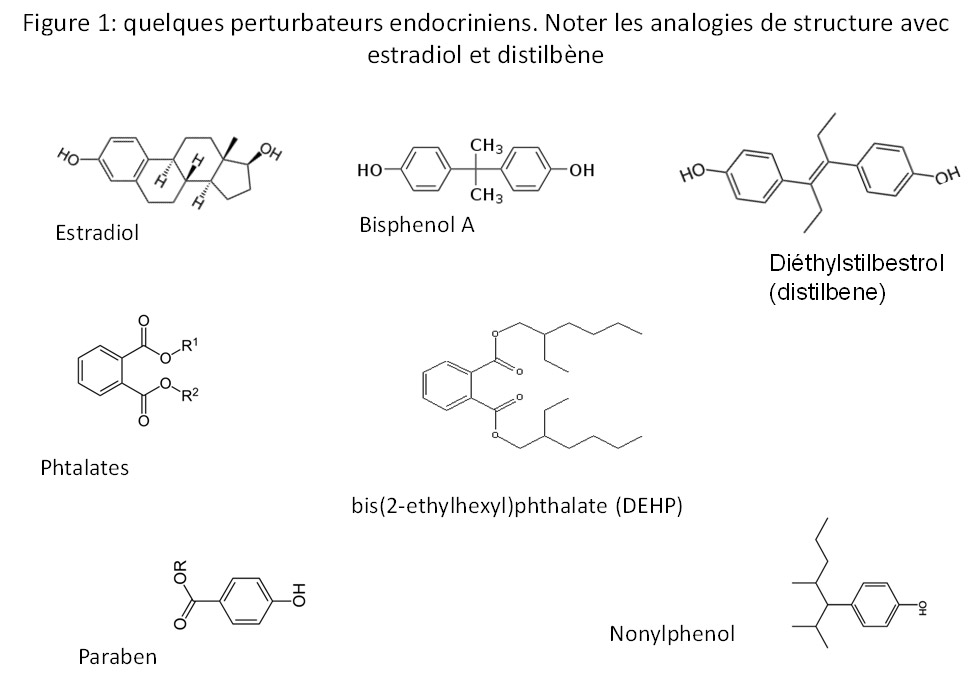
Introduction
Les perturbateurs ou disrupteurs endocriniens sont des molécules hormono-mimétiques qui interférent avec les équilibres endocriniens. Le plus souvent, mais pas toujours, ce sont des Xénoestrogenes qui sont en tout cas les plus connus. Ils agissent à de faibles doses et ont des effets insidieux. L’histoire de ces composés a sans doute commencé avec le DDT, dès les années 60 et les écrits de Rachel Louise Carson (the Silent Spring), une biologiste américaine, qui a mis en cause ses effets cancérigènes et reprotoxiques. Les composés utilisés dans la technologie du plastique comme les PCBss (polychlorinated bisphenyls), bisphenols, phtalates, alkylphenols mais aussi dans la cosmétique (parabens) ont ces potentialités négatives. Ils sont manipulés quotidiennement dans la vie de tous les jours. Leur utilisation simultanée et/ou séquentielle amène à un effet cocktail cumulatif. Indépendamment des effets hormonaux, ils sont pour la plupart, inducteurs du stress oxydant (SO). Ceci implique une possible altération de l’ADN via l’oxydation des bases ou la formation d’adduits. L’effet cumulatif (cocktail) de ces dégâts peut bien sur amener à la génération des cancers ou plus insidieusement à transmettre aux descendants des pathologies d'origine épigénétique.
Les principaux perturbateurs endocriniens
- Toxique

- Dangereux

De nombreuses substances dans l’environnement domestiques ou professionnel sont directement ou indirectement reprotoxiques. (1 et 2). Le program REACH « registration, Evaluation and Authorization of Chemicals" , programme européen, est en charge de l’évaluation et du marquage des nouvelles molécules, mises sur le marché. Cependant, 95% des produits chimiques échappent à ce processus d’évaluation ou manquent de protocoles corrects d’analyse. Il est admis que 70% des molécules nouvelles ne seront jamais testées.
Les plastiques contenant des produits comme les Bisphenols notamment le bisphenol A (BPA), le bis(2-ethylhexyl)phthalate (DEHP) et le di-butyl phtalate (DBP), sont présents partout. Ils servent le plus souvent à « assouplir » les plastiques et les rendre moins cassants. Les phtalates et le BPA sont retrouvés dans les urines de toutes les femmes et notamment les femmes enceintes (Vandenberg et al. 2010, Ferguson et al. 2014). Pour European Food Safety Authority (EFSA). La dose moyenne journalière ingérée ne doit pas dépasser 50 microgrammes/Kg. Cependant le BPA impacte négativement l’activité mitochondriale (augmentation du stress oxydant) pour des valeurs bien plus faibles. Le BPA peut induire des dommages à l’ADN via son activité oestrogénique. (Cf noter les analogies de structure entre estradiol, distibene et BPA, figure 1)
Parfois les métabolites issus de la dégradation de ces composés sont encore plus toxiques que le produit natif. C’est le cas du DEHP transformé en MEHP cancérigène epigénétique. Le DEHP est présent dans les plastiques des jouets pour (très jeunes) enfants qui bien évidemment les portent abondement à la bouche. Les éthers du glycol sont utilisés en blanchisserie (détergents, émulsifiants), parfumerie et même dans des préparations médicinales. Nonylphenols et alkylphenols, d’autres perturbateurs endocriniens sont utilisés dans les lave-vaisselles. Les pesticides dits phytosanitaires, sont bien sûr des composés le plus souvent à effet perturbateur endocrinien. Le plus connu est le Lindane ayant un effet estrogénomimetique absolu. Pour Sultan et al. (2001) les pesticides utilisés en agriculture viti-vinicole sont inducteurs du « micro pénis syndrome ». Il est couramment admis que l’Atrazine et le glyphosate (round up) affectent la fertilité masculine.
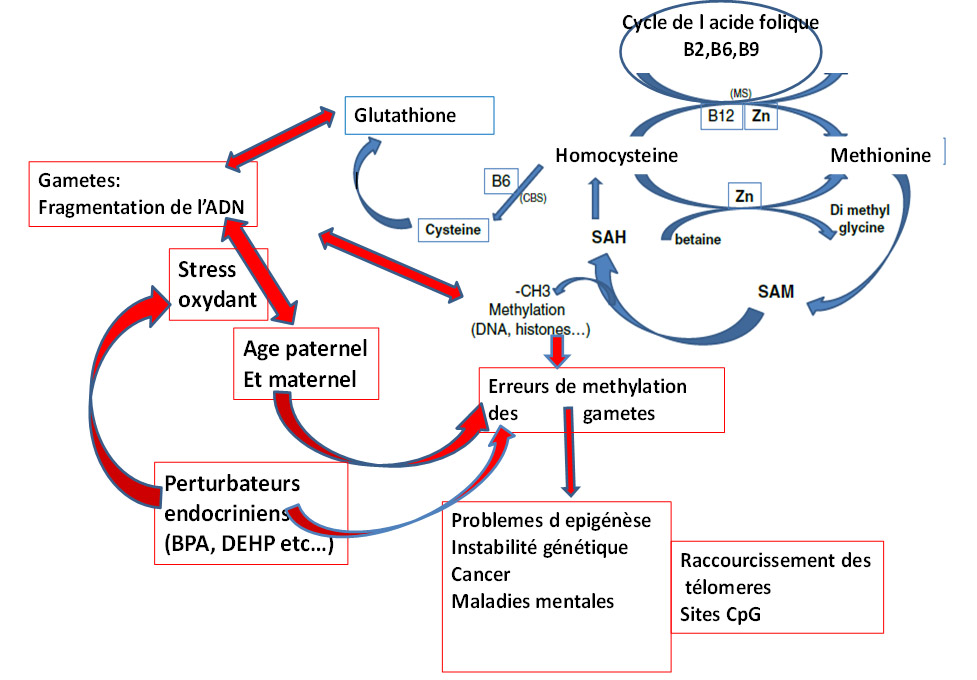
La figure 2 indique la relation entre perturbateurs endocriniens, le processus de methylation (« one carbon cycle ») et la défense contre le stress oxydant. Les EDs bloquent la synthèse de glutathion et augmente la concentration en Homocysteine qui est un poison cellulaire universel.
Disrupteurs endocriniens et fertilité de l homme.
L’analyse des effets négatifs des EDs est plus facile chez l’homme. Les EDs affectent négativement les deux paramètres les plus importants de l’ADN du noyau: la fragmentation de l’ADN (DFI: DNA fragmentation index), et la décondensation de la chromatine (SDI: sperm décondensation index i.e. compaction du noyau). De plus, les EDs (en particulier le BPA) perturbent la methylation de l’ADN (Mannikam et al. 2013), ce qui induit des modifications epigénétiques trangénérationnelles et nombres de pathologies associées comme l’obésité. Via l’effet générateur de stress oxydant et des molécules ROS (reactive oxygen species), les Eds induisent la fragmentation de l ADN et la formation d’adduits tells la 8 oxo deoxyguanosine qui est mutagène (Guo et al. 2015). La quantité de phtalates dans les urines est complètement corrélée à la formation de 8 oxo deoxyguanosine, une mauvaise motilité des spermatozoïdes (Bloom et al. 2015), mais aussi à une numération et une concentration diminuées ainsi qu’une morphologie altérée des spermatozoïdes. Les anomalies de la tête (notamment acromégalie), signant d’une mauvaise compaction de l’ADN, sont très fortement augmentées.
Comme indiqué précédemment, les herbicides, pesticides (PCB) et autres plastifiants peuvent avoir pour cible le testicule fœtal avec pour conséquence un augmentation des pathologies comme l’hypospade, la cryptorchidie, une ambivalence sexuelle, un micro-pénis dans un cadre appelé TDS : testicle dysgenesis syndrome (TDS), (Sultan et al. 2001, Gaspari et al; 2012, Eladak et al. 2015).
Disrupteurs endocriniens et fertilité de la femme.
Ovaire/ovocyte:
Les Eds entrainent chez l’animal, des lésions ovariennes semblables à celles observées dans l’endométriose (Caseta et al. 2008, Signorile et al. 2012). Les ovaires polykystiques, une autre importante pathologie ovarienne sont, semble-t-il très liés au BPA, une corrélation significative est observée entre teneur en BPA dans le sérum et la présence d’OPKs (Palioura et Diamanti-Kandarakis 2013) Le lien avec le stress oxydant est aussi, plus que probable. L’une des questions majeures est de déterminer si l’exposition des futures mères à ces produits aura aussi un impact sur la descendance. Il est difficile d’analyser les ovocytes du fait de la rareté et la difficulté d’accès du matériel biologique (contrairement aux spermatozoïdes). Ce que l’on sait : ces perturbateurs endocriniens ont un effet négatif sur la methylation de l’ADN (Hoffman 2011, Ménézo et al 2011, 2015). Ceci implique des anomalies au niveau des maladies à empreinte (imprinting diseases), mais aussi et peut être surtout des anomalies epigénétiques. En effet chez l’animal, BPA, DEHP and DBP induisent dans la descendance obésité, hyperglycémie et autres maladies métaboliques (Manikkam et al. 2013, Song et al. 2014). Ceci est à mettre en parallèle avec une augmentation de la prévalence de l’obésité. Ce processus serait aussi responsable de l’accroissement de la fréquence de l’autisme (ASD disorders) et autres maladies mentales chez l’enfants. La ménopause précoce et/ou la résistance à la stimulation ovarienne ont une étiologie sous jacente, liée aux disrupteurs endocriniens (Kumar et al. 2010, Mok lin et al. 2010). Plus la quantité des Eds est importante dans les urines, plus la réserve ovarienne est affaiblie. Par ailleurs, la perturbation de la synthèse de glutathion affecte la qualité de l’ovocyte (Tsai-Turton and Luderer 2006), notamment via une maturation cytoplasmique défectueuse qui ne permettra pas la décondensation correcte du noyau du spermatozoïde. Ceci amènera alors à des arrêts de développement embryonnaire précoce. La qualité de l’ADN sera affectée notamment au niveau des télomères et des ilots CpG responsable de la régulation de l’épigénèse. Les télomères ovocytaires commencent a décroitre durant le vie fœtale puis lors de la vie adulte sous influence de génotoxicité. Il est connu que les femmes ayant des échecs répétés de FIV ont des télomères ovocytaires pus courts. L’augmentation de l’homocystéine peu avoir des effets délétères par ailleurs complètement opposés. Une inhibition de la methylation (et de l’épigénèse) peut entrainer, par effet rebond, une hypermethylation de certains promoteurs susceptible de déclencher des cancers à plus ou moins long terme. L’homocystéine est délétère pour l’ovogénèse. Ebisch et al. (2006) ont confirmé la relation entre homocysteine et qualité de la methylation. Il existe une corrélation négative entre la concentration d’homocysteine dans le follicule et la qualité de l’ovocyte (Ebisch et al. 2006, 2007).
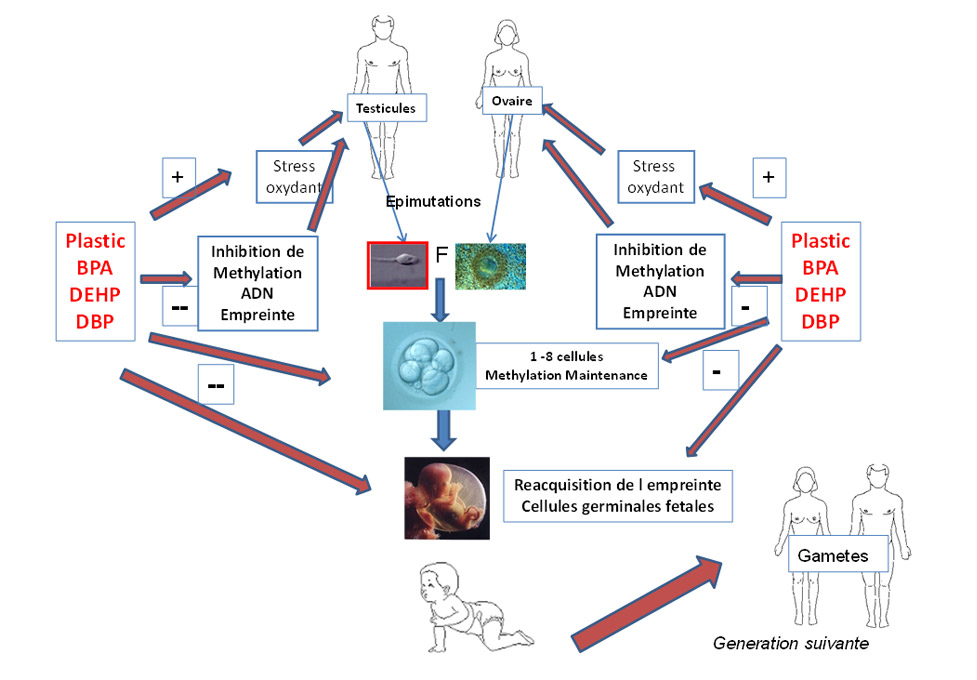
Bien plus grave sans doute est l’impact que cela peut avoir tout au long de la grossesse, sur la descendance (Figure 3) directement ou via des anomalies des gamètes.
L’embryon
Le poids sec d’un embryon préimplantatoire est d’environ 75 -100 nano grammes. Les conséquences d’un environnement perturbateur, quel qu’en soit sa nature, seront dramatiques. L’effet générateur de ROS affectera l’ADN mitochondrial, qui est, rappelons le, transmis par la mère, mais aussi les lipides et les protéines embryonnaires. Normalement le site de la fécondation et du développement embryonnaire précoce est protégé par des systèmes antioxydant redondants (Guerin et al. 2001). Cependant, il est plus que probable que les EDs, transportés par le sang, passent comme les stéroïdes la paroi tubaire. Par ailleurs il se produit un déclin progressif de ces protections en fonction de l’âge maternel. Les polyamines ; spermine et spermidine très actives dans le développement embryonnaire précoce (Menezo et al. 2013) nécessitent pour leur synthèse, le donneur de methyl universel, la S Adenosyl méthionine. Là encore les EDs peuvent avoir un impact négatif en freinant le recyclage de l’homocysteine en méthionine. De même ils perturberont la synthèse de glutathion, absolument nécessaire de la fécondation (pour la décondensation de la tête du spermatozoïde) et le développement au stade blastocyste. Aux stades préimplantatoires, une methylation de l’ADN est nécessaire pour le processus de l’empreinte (Arand et al. 2015, Selsenberger et al. 2012 voire figure 3). La perturbation de la methylation et du recyclage de l’homocystéine sont d’ autant plus gênantes que l’embryon est déjà assez mal équipé pour les réaliser (Menezo et al. 2013). Ceci amène a un déficit en cystéine puis en glutathion: nous sommes en présence d’un cercle vicieux.
Uterus, implantation, corps jaune.
Il est admis qu’environ 15% des femmes souffrent d’endométrioses, et c’est plutôt l’aspect « estrogen- like « qui est en cause. Les PCBs, la dioxine tout comme le BPA (Upson et al. 2014) sont des effecteurs majeurs de cette pathologie.
L implantation requiert un trialogue embryon, utérus, corps jaune. Toute perturbation liée au stress oxydant amènera à des échecs d’implantation. Toute genèse de stress oxydant non régulée conduira à la lutéolyse. Il est aussi important de rappeler ici que le processus de méthylation a un impact majeur pour le fonctionnement du trophoblaste et l’implantation (Serman and Dodig 2013). Il est plus qu’évident qu’un certain nombre d’échecs d implantations ou d’avortements répétitifs trouvent leur origine dans ces dysfonctionnements.
Grossesse
Deux aspects différents doivent être évalués.
Le premier est le rôle des EDs dans la genèse du stress oxydant et de leurs dégâts. Via ces effets négatifs, les EDs pourront générer fausses couches, retards de croissance, malformations fœtales, pre-éclampsie, diabète et obésité.
Le deuxième, probablement plus pervers et plus discret, dans un premier temps, est la dérégulation de l’épigénèse avec les conséquences trangénérationnelles (Ménézo et al. 2015, Figure 2 et 3). Les conséquences en seront l’apparition de maladies métaboliques qui perdureront de générations en générations. Il est absolument évident pour nous que l’augmentation de la prévalence de l’obésité n’est pas seulement liée à des modifications de l’alimentation mais aussi à l’effet de ces EDs De même ces EDs amèneront à l’apparition de pathologies psychiques.
Chez l’enfant
Chez la jeune fille, un des effets les plus connus est la puberté précoce mais il est plus que probable que les pathologies ovariennes et utérines leurs sont dues. L’analogie de structure entre BPA et Diethylstilbestrol (DES) de triste mémoire est à la fois frappante et inquiétante. De même rappelons les pathologies type hypospade, TDS etc… générées chez le jeune garçon.
Conclusions
Les Eds sont un vrai problème de santé qui concerne la fertilité, d’autres fonctions endocrines et plus largement le métabolisme. Par leurs aspect « générateurs » de ROS, et ou directement (via les récepteurs aux estrogènes) ils sont plus que probablement initiateurs de cancers comme le cancer du sein et du tractus génital. Les doses seuils ne signifient pas grand-chose si l’on prend en compte « l’effet cocktail » de ces nombreuses molécules qui se surajoutent. Si l’on considère la relation entre stress oxydant, inhibition de la methylation et EDs, il est tout à fait évident que les antioxydants classiques pris par voie orale, abondamment accessibles dans tous type de commerces ne sont absolument pas efficaces. Nous avons pu montrer par ailleurs (Brack et al. 2013) qu’il n’existe jamais de carences en vitamines C, E, A et que ces molécules sont souvent contre –indiquées. A contrario, les vitamines du groupe B, qui supportent la régénération de l’homocystéine en cystéine sont d’importance majeure. Elles permettent d’éviter la dérégulation de la methylation et son cortège de pathologies liées a l’instabilité du DNA et de son profil épigénétique. Nous avons pu montrer, dans le cadre de l’infertilité tant masculine que féminine (Cornet et al. 2015) que ce support de méthylation (Procrelia® homme , Procrelia® femme laboratoires Nurilia Lyon) permet d’obtenir un pourcentage non négligeable de grossesses spontanées chez des couple ayant subi des échecs répétés de FIV. Par ailleurs, il n’apparait pas inutile de proposer ce type de support avant tout désir d’enfant et sans doute aussi pendant la grossesse, surtout aux périodes sensibles de maintien de l’épigénèse (Ménézo et al. 2015)
Arand J Wossidlo M, Lepikhov K et al. 2015 Selective impairment of methylation maintenance is the major cause of DNA methylation reprogramming in the early embryo. Epigenetics Chromatin.8:1.
Bloom MS, Whitcomb BW, Chen Z et al. 2015 Associations between urinary phthalate concentrations and semen quality parameters in a general population. Hum Reprod. 30:2645-57
Brack M, Brack O, Menezo Y et al. 2013 Distinct profiles of systemic biomarkers of oxidative stress in chronic human pathologies: Cardiovascular, psychiatric, neurodegenerative, rheumatic, infectious, neoplasmic and endocrinological diseases. Adv. Biosci. Biotech, 4:331-339
Caserta D1, Maranghi L, Mantovani A et al.2008 Impact of endocrine disruptor chemicals in gynecology. Hum Reprod Update. 14:59-72.
Cornet D, Amar E, Cohen M et al. 2015 Clinical Evidence for the Importance of 1-Carbon Cycle Support in Subfertile couples Austin J Reprod Med Infertil. 2: 1011.
Ebisch IM, Peters WH, Thomas CM et al. 2006 Homocysteine, glutathione and related thiols affect fertility parameters in the (sub) fertile couple. Hum. Reprod. 21: 1725–33.
Ebisch IM, Thomas CM, Peters WH 2007 The importance of folate, zinc and antioxidants in the pathogenesis and prevention of subfertility. Hum. Reprod. Update 13: 163–74.
Eladak S, Grisin T, Moison D et al. 2015 A new chapter in the bisphenol A story: bisphenol S and bisphenol F are not safe alternatives to this compound. Fertil Steril. 103:11-21
Ferguson KK, McElrath TF, Chen YH et al. 2015 Urinary Phthalate Metabolites and Biomarkers of Oxidative Stress in Pregnant Women: A Repeated Measures Analysis. Environ Health Perspect. 123:210-6
Gaspari L, Sampaio DR, Paris F et al. 2012 High prevalence of micropenis in 2710 male newborns from an intensive-use pesticide area of Northeastern Brazil. Int J Androl. 35:253-64
Guérin P, El Mouatassim S, Ménézo Y 2001 Oxidative stress and protection against reactive oxygen species in the pre-implantation embryo and its surroundings. Hum Reprod Update. 7:175-89.
Guo Y, Weck J, Sundaram R, Goldstone AE et al. 2014 Urinary concentrations of phthalates in couples planning pregnancy and its association with 8-hydroxy-2'-deoxyguanosine, a biomarker of oxidative stress: longitudinal investigation of fertility and the environment study Environ Sci Technol. 48:9804-11.
Hoffman, M. 2011 Hypothesis: hyperhomocysteinemia is an indicator of oxidant stress. Med. Hypotheses 77, 1088–93.
Kumar M, Pathak D, Kriplani A et al. 2010 Nucleotide variations in mitochondrial DNA and supra-physiological ROS levels in cytogenetically normal cases of premature ovarian insufficiency. Arch Gynecol Obstet. 282:695-705
Manikkam M, Tracey R, Guerrero-Bosagna C et al.2013. Plastics derived endocrine disruptors (BPA, DEHP and DBP) induce epigenetic transgenerational inheritance of obesity, reproductive disease and sperm epimutations PLoS One, 8:1:e55387.
Ménézo, Y., Mares, P., Cohen, M et al. 2011 Autism, imprinting and epigenetic disorders: a metabolic syndrome linked to anomalies in homocysteine recycling starting in early life? J. Assist. Reprod. Genet. 28: 1143–5.
Ménézo Y, Lichtblau I, Elder K 2013 New insights into human pre-implantation metabolism in vivo and in vitro. J Assist Reprod Genet. 30:293-303
Menezo YJ, Elder K, Dale B.2015 Link Between Increased Prevalence of Autism Spectrum Disorder Syndromes and Oxidative Stress, DNA Methylation, and Imprinting: The Impact of the Environment. JAMA Pediatr. 169:1066-7.
Mok-Lin E, Ehrlich S, Williams PL et al. 2010 Urinary bisphenol A concentrations and ovarian response among women undergoing IVF. Int J Androl 33:385-93
Palioura E1, Diamanti-Kandarakis E 2013Industrial endocrine disruptors and polycystic ovary syndrome. J Endocrinol Invest.):1105-11.
Seisenberger S, Andrews S, Krueger F, et al. 2012 The dynamics of genome-wide DNA methylation reprogramming in mouse primordial germ cells. Mol Cell. 48:849-62
Serman L and Dodig D.2011 Impact of DNA methylation on trophoblast function. Clin Epigenetics. 1:3:7.
Signorile PG1, Spugnini EP, Citro G et al. 2012 Endocrine disruptors in utero cause ovarian damages linked to endometriosis. Front Biosci (Elite Ed). 2012 Jan 1;4:1724-30.
Song S, Zhang L, Zhang H et al. 2014 Perinatal BPA exposure induces hyperglycemia, oxidative stress and decreased adiponectin production in later life of male rat offspring. Int J Environ Res Public Health. 11:3728-42
Sultan C, Balaguer P, Terouanne B et al. 2001 Environmental xenoestrogens, antiandrogens and disorders of male sexual differentiation. Mol Cell Endocrinol. 178:99-105
Tsai-Turton M, Luderer U 2006 Opposing effects of glutathione depletion and follicle-stimulating hormone on reactive oxygen species and apoptosis in cultured preovulatory rat follicles. Endocrinology 147:1224-36
Upson K, Sathyanarayana S, De Roos AJ 2014 A population-based case-control study of urinary bisphenol A concentrations and risk of endometriosis. Hum Reprod. 29:2457-64.
Vandenberg LN, Chahoud I, Heindel JJ. et al. 2010 Urinary, circulating, and tissue biomonitoring studies indicate widespread exposure to bisphenol A. Environ. Health Perspect. 118: 1055–1070
Figure 2 : relation entre stress oxydant (SO) et anomalies de la methylation. Les flèches rouges indiquent les points d interférences négatives du SO et des Eds sur le metabolisme normal (1-C cycle)
Figure 3
Stades critiques et modifications epigénétiques affectées par les EDS
Les Eds affectent la methylation des gamètes et affectent le processus epigénétiques : ceci affectera la qualité constitutive de l embryon
Puis ils affecteront le processus de transmission des marques epigénétiques aux stades pré-implantatoires , puis lors de le genèse des cellules germinales