Mise au point collégiale rédigée par : Marion Bonnier de la Chapelle, Oriane Lassartesse, Clémence Delcour, Brigitte Raccah-Tebeka
Service de gynéco-obstétrique, Hôpital Robert Debré, Paris
L’hyperthyroïdie est retrouvée chez 2 à 3 % des femmes pendant la grossesse.
Les principales étiologies sont :
- Hyperthyroïdie gestationnelle transitoire : 1-3%
- Maladie de Basedow : 0.4-1% avant grossesse et 0.2% pendant la grossesse
- Goitre multi nodulaire ou nodule toxique : rare
Un suivi multidisciplinaire est nécessaire dans les 2 derniers cas avec endocrinologue, gynécologue obstétricien, échographiste spécialisé et pédiatre.
Les principaux risques de l’hyperthyroïdie durant la grossesse sont :
- Fausse-couches spontanées précoces (Selon l’étude de Momotani et Ito (1) , les taux seraient augmentés de 26% par rapport à ceux rencontrés dans une population témoin de patientes euthyroïdiennes qui seraient de 13%)
- Prématurité (Selon l’étude de Momotani et Ito, les taux seraient augmentés de 15% par rapport à ceux rencontrés dans une population témoin de patientes euthyroïdiennes qui seraient de 9,5%)
- Malformations congénitales à type d’anencéphalie, d’imperforation anale ou de fente labio-palatine.
- D’autres complications peuvent se rencontrer, d’autant plus sévères que l’hyperthyroïdie maternelle est insuffisamment corrigée : pré-éclampsie, hématome rétro-placentaire, césarienne, insuffisance cardiaque à haut débit, crise aiguë thyrotoxique.
- Les TRAK (anticorps anti récepteur de la TSH) pouvant traverser la barrière placentaire, il existe également un risque d’hyperthyroïdie fœtale.
Les dernières recommandations publiées concernant la prise en charge des dysthyroïdies pendant la grossesse sont celles de l’American Thyroid Association en 2017 (2).
Un dosage de la TSH en début de grossesse doit être proposé chez certaines patientes :
- Pathologie thyroïdienne connue (hypothyroïdie, hyperthyroïdie, maladie de Basedow (y compris si thyroïdectomie ou IRA thérapie), nodules thyroïdiens, antécédent de chirurgie thyroïdienne ou de radiothérapie cervicale)
- Goitre ou nodule thyroïdien à l’examen clinique
- Antécédents familiaux de dysthyroïdie
- Femmes à risque (antécédent personnel de diabète de type 1 et maladie auto-immune)
- Signes cliniques évocateurs d’hyperthyroïdie : tachycardie maternelle persistante, absence de prise de poids régulière, vomissements d’intensité inhabituelle se prolongeant au-delà du 1er trimestre de grossesse.
Si la TSH est retrouvée abaissée, des dosages de la T4L et T3L dans un premier temps, complété éventuellement par le dosage d’anticorps anti TPO, anti TG et TRAK doivent être effectués. Une TSH abaissée seule ne pouvant affirmer l’hyperthyroïdie en cours de grossesse.
La scintigraphie thyroïdienne est contre-indiquée pendant la grossesse. Une échographie thyroïdienne doit être réalisée en l’absence d’échographie récente de moins de 1 an. Elle permet diagnostiquer une maladie de Basedow si un goitre vasculaire est retrouvé, une poussée de thyroïdite de Hashimoto en cas d’aspect échographique évocateur ou de nodule toxique ou goitre multinodulaire toxique plus rarement.
Hyperthyroïdie gestationnelle, cas le plus fréquent
Le diagnostic d’hyperthyroïdie transitoire de début de grossesse peut être posé :
- en cas d’hyperthyroïdie (TSH diminuée avec T3 et/ou T4 augmentées)
- avec TRAK, anticorps anti-TPO, anticorps anti-TG négatifs
- et en l’absence d’anomalie échographique thyroïdienne évocatrice d’un nodule toxique
Par définition, une résolution spontanée de l’hyperthyroïdie survient avec l’avancée de la grossesse (en général au 2e trimestre de la grossesse vers 16-20 SA). La physiologie du début de grossesse explique ce phénomène : l’HCG a un effet TSH-like et stimule la thyroïde maternelle avec production d’hormones thyroïdiennes qui, par rétrocontrôle hypophysaire, abaissent à leur tour la TSH. Ainsi, à partir de la 6e SA, la concentration plasmatique de TSH suit une courbe inverse de celle de l’HCG qui culmine à la 12e SA (Figure 1). De ce fait, une diminution isolée de la TSH est fréquente au 1er trimestre et sans signification pathologique (15 % de femmes enceintes en bonne santé ont une TSH < 0.4 mUI/L au 1er trimestre). Un traitement symptomatique seul peut être mis en place si besoin mais l’hyperthyroïdie gestationnelle ne nécessite jamais un traitement par antithyroïdiens de synthèse (ATS).
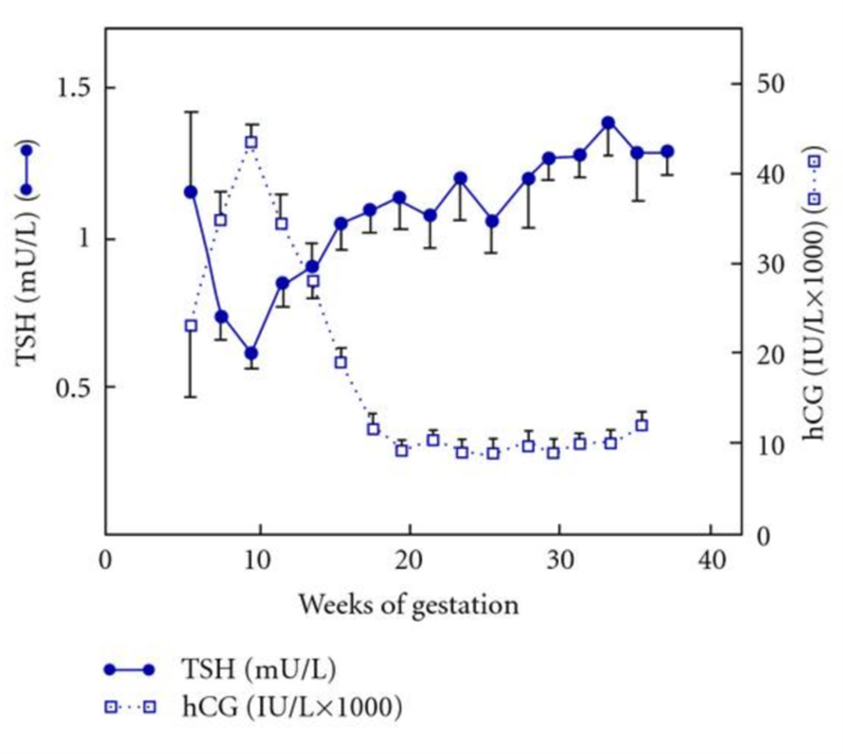
Figure 1 : Variation de la TSH et HCG au cours de la grossesse
Un suivi des dosages de TSH, T3L et T4L est recommandé de façon mensuelle. Après normalisation du bilan confirmé à deux reprises, la surveillance pourra être interrompue. Il n’est pas nécessaire de faire de bilan particulier chez le nouveau-né, en dehors de la surveillance habituelle.
Maladie de Basedow en cours de grossesse
Maladie de Basedow antérieure à la grossesse et traitée médicalement ou découverte en cours de grossesse
Avant une grossesse, l’objectif est d’obtenir une euthyroidie biologique. Si possible (patiente jeune et bonne réserve ovarienne), le mieux est de proposer à la femme d’attendre la guérison de la poussée de Basedow avant d’entreprendre une grossesse et une contraception efficace doit être proposée pendant la durée du traitement antithyroïdien (ATS). Dans certains cas cependant, une grossesse survient alors que la patiente est en cours de traitement par ATS ou une maladie de basedow est découverte en cours de grossesse.
Evolution de la maladie de Basedow pendant la grossesse
La maladie de Basedow évolue beaucoup plus rapidement en cours de la grossesse qu’en dehors de la grossesse. En effet, il existe un risque important de rechute de la maladie de Basedow au premier trimestre de la grossesse. Puis la tolérance immunitaire liée à la grossesse permet dans la grande majorité des cas une amélioration voire une rémission de la maladie de Basedow permettant souvent de diminuer les doses de traitements antithyroïdiens voire de les stopper totalement. Pour cette raison, la surveillance des bilans thyroïdiens maternels doit être rapprochée pendant la grossesse afin de permettre une adaptation des traitements ATS rapide et éviter le surdosage.
Traitement antithyroïdien et objectifs en cours de grossesse :
Lors du 1er trimestre de grossesse, les thiouraciles (propylthiouracile : Propylex par exemple) devront être préférés au imidazolés (carbimazole : Néomercazole par exemple) en raison de leur moindre tératogénicité. L’équivalence entre les traitements est telle que la dose de propylthiouracile est égale à 20 x la dose de carbimazole (exemple : 5mg de carbimazole = 100 mg de propylthiouracile).
Lors du 2ème trimestre, le traitement pourra être poursuivi par propylthiouracile ou remplacé par carbimazole (risque moins important de cytolyse hépatique mais risque de pancréatite aigüe et de neutropénie).
La surveillance est la même quel que soit le traitement choisi. Le premier mois, une surveillance de la NFS est nécessaire de façon hebdomadaire pour dépister une rare mais possible neutropénie. Par la suite, la surveillance de l’hémogramme et du bilan hépatique est recommandée de façon mensuelle pendant le traitement par ATS.
Le suivi de la TSH et de la T4L doit être effectué au minimum toutes les 4 semaines. Le traitement devra être diminué progressivement selon l’évolution des dosages et poursuivi à la dose minimale efficace, en raison du passage placentaire de tous les ATS. En effet, une hypothyroïdie fœtale avec goitre fœtal peut apparaitre à partir de 150 mg par jour de propylthiouracile, ce dosage ne devra donc jamais être dépassé. L’objectif est d’obtenir une T4L à la limite supérieure de la normale sans essayer de normaliser la TSH. L’association de L-thyroxine et ATS (méthode « blocage-substitution ») n’est pas recommandée pendant la grossesse car est à fort risque de goitre fœtal.
La thyroïdectomie totale est possible, en cas d’échec ou intolérance aux ATS, pendant la grossesse en particulier au 2ème trimestre lorsque le risque de fausse-couche spontanée ou mort fœtale in utero est le plus faible. Cette chirurgie est et doit rester exceptionnelle, car la tolérance immunitaire en cours de grossesse entraine une résolution spontanée fréquente de la maladie de Basedow. L’IRAthérapie est, en revanche, contre-indiquée pendant la grossesse.
Si la maladie de Basedow était traitée avec de faibles doses d’ATS (carbimazole < 5-10mg/j) avant la grossesse, un arrêt du traitement en début de grossesse peut être discuté avec suivi de la TSH et T4L toutes les 1 à 2 semaines au 1er trimestre puis toutes les 2 à 4 semaines au 2e et 3e trimestres.
Maladie de Basedow traitée radicalement
Si la maladie de Basedow a été traitée radicalement avant la grossesse (thyroïdectomie ou IRAthérapie), un délai de 6 mois est recommandé avant la conception.
Chez les femmes qui ont bénéficié d’un traitement radical avant la grossesse, un dosage de TRAK est nécessaire en début de grossesse :
- Si les TRAK sont bas (inférieur à 3N ou 5 UI/L), il n’y a pas d’indication à un suivi particulier pour le fœtus car il n’y a pas de risque de dysthyroïdie fœtale.
- Si les TRAK sont élevés (supérieurs à 3N ou 5 UI/L), un contrôle des TRAK à 20 SA puis à 32 SA ainsi qu’une surveillance de la thyroïde fœtale mensuelle dès 18 SA est nécessaire car il existe un risque d’hyperthyroïdie fœtale.
En cas de découverte d’un goitre fœtal d’hyperthyroïdie chez le fœtus en cours de grossesse, un traitement par ATS pourra être envisagé chez la mère afin de traiter l’hyperthyroïdie de son fœtus. Toutefois cette décision de traitement doit reposer sur un avis d’expert après discussion multidisciplinaire dans un CPDPN.
Concernant la surveillance maternelle, outre les dosages de TRAK, le dosage de la TSH mensuelle doit être effectué comme n’importe quelle hypothyroïdie en cours de grossesse. Les objectifs de TSH sont les mêmes que pour les autres causes d’hypothyroïdies (hors traitement freinateur).
Surveillance fœtale en cours de grossesse
En début de grossesse, en cas de dosage des TRAK supérieur à 3 fois la normale ou supérieur à 5UI/L, il existe un risque d’hyperthyroïdie fœtale nécessitant une surveillance fœtale accrue par échographie de la thyroïde fœtale mensuelle à partir de 18 SA à la recherche d’un goitre fœtal. A contrario, il existe un risque d’hypothyroïdie fœtale en cas de traitement par ATS (notamment pour des doses de PTU supérieures à 150 mg/j ou supérieures à 15mg de Néomercazole) qui nécessite également une surveillance fœtale accrue à partir de 18 SA à la recherche d’un goitre fœtal. En effet, le fœtus acquiert les récepteurs de la TSH à partir de 18 SA environ et c’est donc à partir de ce terme qu’il devient réceptif au TRAK et aux ATS. L’échographie de la thyroïde fœtale n’est pas un examen aisé et il est ainsi recommandé que celle-ci soit réalisée par un échographe référent.
Si un goitre fœtal est mis en évidence lors du suivi en cours de grossesse, il convient de déterminer si ce goitre fœtal est secondaire à une hypothyroïdie ou une hyperthyroïdie fœtale. Certains signes échographiques peuvent orienter vers l’une ou l’autre des étiologies mais malheureusement aucun de ces signes n’est spécifique. L’équilibre des bilans maternels peut alors également orienter vers l’une ou l’autre des étiologies de goitre fœtal.
Classiquement, certains signes d’appels sont en faveur d’une hyperthyroïdie fœtale :
- Tachycardie fœtale supérieure à 160/min
- Oligoamnios
- Accélération de la maturation osseuse (avance de plus de 2 semaines dans l’apparition des points d’ossification de Béclard et de Todt)
- Retard de croissance intra-utérin
- Goitre fœtal avec hypervascularisation parenchymateuse (visible à partir de 20 SA)
Et d’autres sont plutôt en faveur de l’hypothyroïdie fœtale :
- Hyperagitation fœtale
- Retard de la maturation osseuse
- Goitre fœtal avec hypervascularisation périphérique
- Absence de bradycardie fœtale, la fréquence cardiaque est normale et n’oriente pas le diagnostic
Ces signes d’appel échographique n’étant pas spécifiques de l’un ou l’autre des troubles thyroïdiens, à savoir l’hypothyroïdie ou l’hyperthyroïdie fœtale, certains auteurs ont développé des techniques permettant d’orienter le diagnostic.
Le diagnostic de certitude fait appel aux dosages des hormones thyroïdiennes libres, de la TSH et des anticorps antithyroïdiens de type stimulant chez le fœtus par une ponction de sang fœtal via cordocentèse (3). Cette méthode apporte un diagnostic de précision sur le trouble thyroïdien grâce à des normes établies pour les différentes hormones. Il faut cependant souligner que ce geste n’est techniquement réalisable qu’à partir de 18-20 SA et comporte un risque de bradycardie fœtale, de chorio-amniotite, de rupture prématurée des membranes, de fausse-couche tardive et de mort fœtale in utero estimé à environ 1 %.
Ainsi, les avis diffèrent quant à la réalisation de ces dosages hormonaux sanguins fœtaux qui ne sont pas nécessaire si les signes échographiques et l’histoire maternelle sont concordants pour orienter l’étiologie d’un goitre fœtal.
Une alternative à la cordocentèse serait un dosage intra-amniotique des hormones thyroïdiennes. L’amniocentèse comporte en effet un risque plus faible de complications que la cordocentèse mais il persiste un risque de fausse couche ou de chorio-amniotite.
Il a été démontré que la TSH maternelle a un très faible passage placentaire, et que les taux amniotiques de TSH et de T4L sont indépendants du statut thyroïdien maternel (4). Le dosage intra-amniotique des hormones thyroïdiennes permettrait donc d’avoir un reflet du statut thyroïdien fœtal.
Face à la discordance des avis sur l’utilisation de cette technique, l’équipe de Luton et al (5) a proposé de fixer une norme permettant de confirmer le diagnostic d’hypothyroïdie fœtale : une TSH amniotique > 2,5 MoM serait fiable pour confirmer le diagnostic.
Afin de donner une ligne de conduite, certains auteurs (5) proposent de recourir à l’amniocentèse en dehors des limites de viabilité du fœtus (<24SA) et de pratiquer la cordocentèse a un âge gestationnel plus avancé, afin de minimiser les risques de prématurité iatrogène.
Quoi qu’il en soit, en cas de découvert d’un goitre fœtal lors de la surveillance échographique, la suite de la prise en charge sera discutée dans un CPDPN.
Post partum
Il existe un risque de récidive de la maladie de Basedow dans le post partum. Un contrôle du bilan biologique avec TSH, T3L, T4L et TRAK est recommandé à 6 semaines du post partum.
Concernant l’allaitement, il existe peu de particularité concernant l’hyperthyroïdie. En effet, il y a un très faible passage du carbimazole à des doses habituelles (max 20 mg/j) ou du PTU (max 250 mg/j) dans le lait permettant ainsi un allaitement dans la quasi totalement des cas. L’allaitement doit par contre est suspendu pendant 3-4 jours après une IRAthérapie.
Nouveau-né de mère suivie pour une maladie de Basedow
Les nouveau-nés de mères traitées par ATS durant la grossesse sont à risque d’hypothyroïdie transitoire néo-natale (en raison du passage des ATS) les 3 à 5 premiers jours de vie. La résolution spontanée est très rapide, en raison de la demie vie faible des ATS et un traitement par L-thyroxine n’est pas nécessaire.
Il existe également un risque d’hyperthyroïdie néo-natale qui dépend de la transmission des TRAK par la mère. Le risque existe lorsque les TRAK sont supérieurs à 3N ou 5 UI/L chez l’enfant à J3. Dans de rares cas, un traitement par ATS peut être instauré (la demie vie des TRAK étant plus longue) mais cette décision repose sur un avis d’endocrinologue pédiatre expert. Cette hyperthyroïdie est également toujours transitoire et le traitement en général n’excède pas 2 à 3 mois maximum.
Ainsi, un dosage de la TSH, T4L, T3L et TRAK au cordon devra être effectué chez tous les nouveaux nés de mère atteinte de maladie de Basedow chez qui un goitre fœtal avait été diagnostiqué ou lorsque les TRAK étaient élevés (>5 UI/L ou > 3 fois la normale) ou en cas de traitement par ATS au 3ème trimestre de la grossesse. Ce bilan devra être ensuite recontrôlé entre le 3ème et le 7ème jour de vie. En cas de TRAK positifs et/ou d’anomalies du bilan thyroïdien chez le nouveau-né, un avis spécialisé sera nécessaire avec suivi régulier du bilan chez le nouveau-né.
Bibliographie
1. Momotani N, Iwama S. [Management of Graves’ disease and hypothyroidism in pregnancy]. Nihon Rinsho Jpn J Clin Med. nov 2012;70(11):1971‑5.
2. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid Off J Am Thyroid Assoc. mars 2017;27(3):315‑89.
3. Thorpe-Beeston JG, Nicolaides KH. Fetal thyroid function. Fetal Diagn Ther. févr 1993;8(1):60‑72.
4. Singh PK, Parvin CA, Gronowski AM. Establishment of reference intervals for markers of fetal thyroid status in amniotic fluid. J Clin Endocrinol Metab. sept 2003;88(9):4175‑9.
5. Luton D, Huel C, Vuillard E, Leguy M-C, Tsatsaris V, Lewin F, et al. Dosage des hormones thyroïdiennes et surrénaliennes dans le liquide amniotique : aide au diagnostic. Ann Biol Clin (Paris). 1 mai 2009;67(3):299‑305.


