Résumé d’article
MTHFR (methylenetetrahydrofolate reductase: EC 1.5.1.20) SNPs (single-nucleotide polymorphisms) and homocysteine in patients referred for investigation of fertility.
Ménézo Y, Patrizio P, Alvarez S, Amar E, Brack M, Brami C, Chouteau J, Clement A, Clement P, Cohen M, Cornet D, Dale B, D' Amato G, Jacquesson-Fournols L, Mares P, Neveux P, Sage JC, Servy E, Huong TM, Viot G.J Assist Reprod Genet. 2021 Apr 29. doi: 10.1007/s10815-021-02200-6. Online ahead of print.PMID: 33914208
De nombreuses études montre depuis plusieurs années que la fertilité humaine décline.
La chute de la qualité du sperme ne fait plus débat, et est largement attribuée aux facteurs environnementaux, notamment les disrupteurs endocriniens (EDCs) connus pour affecter la méthylation de l’ADN et l’épigénèse, par des processus de stress oxydant. Les anomalies du méthylome spermatique sont dorénavant considérées comme l’une des causes les plus sérieuse d’infertilité, car génératrice de pathologies du développement à tous les stades embryonnaires
Il est probable que ce même mécanisme affecte également les processus d’ovogénèse.
C’est en partie pour ces raisons que l’assistance médicale à la reproduction ne permet pas de résoudre tous les types d’infertilité.
Les processus d’oxydation de la cellules (y compris des gamètes) est étroitement lié au cycle des folates, co-facteurs de la régénération de l’homocystéine, produit toxique pour la cellule.
La MTHFR (Methylène Tetrahydrofolate Réductase) est une enzyme clé du cycle des folates, permettant la synthèse du 5 MTHF (5 methyl tetrahydrofolate) nécessaire à la régénération de l’homocystéine. Le gène MTHFR est soumis à des polymorphismes (mutations d’une base), entrainant la modification d’un acide aminé de la protéine, qui affecte sensiblement l’activité de l’enzyme. Les deux isoformes les plus pénalisantes sont la C677T et A1298C. La diminution de l’activité de l’enzyme entraine une accumulation de l’homocystéine, entrainant à la fois une augmentation du processus oxydatif et une altération du processus de méthylation.
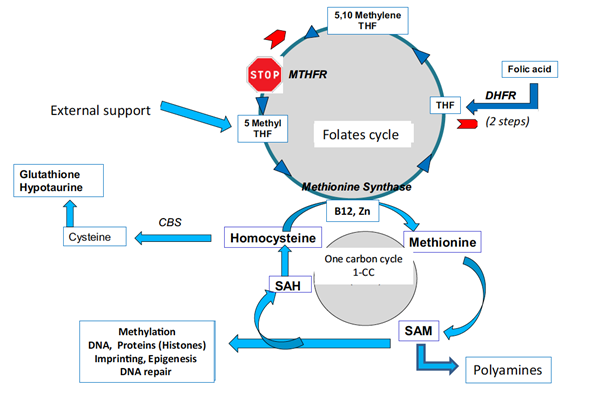
Nous avons testé sur plus de 2900 patients, souffrant d’infertilité lourde liée a des échecs d’Assistance Médicale à la Procréation (2 à 9) ou de fausses couches récurrentes (2 à10), la présence de ces deux isoformes et la teneur en homocystéine circulante.
Nous n’avons pas trouvé de différences significatives entre hommes et femmes quant à la prévalence des 2 isoformes. Mais dans cette population, plus de 40% des patients, quel que soit le sexe, sont homozygotes pour l’une des isoformes ou hétérozygotes composites avec augmentation des valeurs d’homocystéine, donc à « risque » accentué d’infertilités et de fausses couches.
L’isoforme C677T est la plus génératrice d’élévation de l’homocystéine avec dans ce cas , une augmentation plus importante de l’homocystéine chez l’homme.
Pour confirmer l’impact négatif des polymorphismes du gène MTHFR en infertilité du couple, nous avons pu montrer que le traitement des patients avec le 5MTHF (Impryl ® , Metafoline® , Tetrafolic®), le composé en aval du blocage MTHFR, permet de résoudre une partie des problèmes d’échecs de FIV et de fausses couches chez les patients porteurs de ces isoformes.
En conclusion, la détermination de ces isoformes, chez la femme et chez l’homme, n’est pas une indication de première intention, mais doit sérieusement être envisagée dans le cas d’infertilités résistantes. Les traitements à base de 5MTHF doivent être proposés, car en cas de mutation du gène MTHFR, l’acide folique n’est pas une réponse adéquate, car il n’est très mal métabolisé, et son accumulation perturbe encore plus les méthylomes gamétiques. Ce mécanisme d’accumulation d’acide folique non métabolisé (UMFA syndrome) est un syndrome qui pose de nombreuses questions.
Enfin, les résultats de ces mutations du gène MTHFR dépistés au cours d’une exploration de couple infertiles doivent être rendus au cours d’une consultation de conseil génétique car les patients doivent être informés des implications médicales de ces mutations chez eux pour d’autres pathologies mais aussi pour leurs enfants et leurs familles, avec proposition d’une enquête familiale.
Télécharger la publication complète
Référence :
The Molecular and Cellular Effect of Homocysteine Metabolism Imbalance on Human Health.
Škovierová H, Vidomanová E, Mahmood S, Sopková J, Drgová A, Červeňová T, Halašová E, Lehotský J.Int J Mol Sci. 2016 Oct 20;17(10):1733.
Oxidative stress and alterations in DNA methylation: two sides of the same coin in reproduction.
Menezo YJ, Silvestris E, Dale B, Elder K.Reprod Biomed Online. 2016 Dec;33(6):668-683. doi: 10.1016/j.rbmo.2016.09.006. Epub 2016 Sep 27
Methylation: An Ineluctable Biochemical and Physiological Process Essential to the Transmission of Life.
Menezo Y, Clement P, Clement A, Elder K.Int J Mol Sci. 2020 Dec 7;21(23):9311. doi: 10.3390/ijms21239311
High doses of folic acid induce a pseudo-methylenetetrahydrofolate syndrome.
Cornet D, Clement A, Clement P, Menezo Y.SAGE Open Med Case Rep. 2019 May 17;7:2050313X19850435. doi: 10.1177/2050313X19850435. eCollection 2019.
5-Methyltetrahydrofolate reduces blood homocysteine level significantly in C677T methyltetrahydrofolate reductase single-nucleotide polymorphism carriers consulting for infertility.
Clément A, Menezo Y, Cohen M, Cornet D, Clément P.J Gynecol Obstet Hum Reprod. 2020 Jan;49(1):101622. doi: 10.1016/j.jogoh.2019.08.005. Epub 2019 Aug 22.
Polymorphisms in the MTHFR gene influence embryo viability and the incidence of aneuploidy.
Enciso M, Sarasa J, Xanthopoulou L, Bristow S, Bowles M, Fragouli E, Delhanty J, Wells D.Hum Genet. 2016 May;135(5):555-568. doi: 10.1007/s00439-016-1652-z. Epub 2016 Apr 11
Oxidative Stress and Polymorphism in MTHFR SNPs (677 and 1298) in Paternal Sperm DNA is Associated with an Increased Risk of Retinoblastoma in Their Children: A Case-Control Study.
Bisht S, Chawla B, Dada R.J Pediatr Genet. 2018 Sep;7(3):103-113.
The pharmacokinetic advantage of 5-methyltetrahydrofolate for minimization of the risk for birth defects.
Bailey SW, Ayling JE.Sci Rep. 2018 Mar 6;8(1):4096



