Introduction
L'endométriose est une maladie gynécologique chronique qui affecte entre 10 et 15 % des femmes en âge de procréer. Parmi les formes d’endométriose, l’endométriose profonde (EP) représente 20 à 35 % des cas et se caractérise par des lésions infiltrant les tissus à plus de 5 mm, parfois associées à des atteintes liées au diagnostic d’infertilité [1, 2].
La physiopathologie de l’infertilité associée à l’EP reste imparfaitement élucidée. Elle pourrait s’expliquer par des adhérences pelviennes, modifiant l’anatomie normale, mais aussi par d’autres mécanismes tels que l’altération des gamètes, des anomalies de fécondation et de développement embryonnaire ou une diminution de la réceptivité endométriale. L’association fréquente d’un endométriome ou d’une adénomyose participe également à la diminution de la fertilité et à l’augmentation du risque de fausse couche [1,2].
La prise en charge thérapeutique de l’infertilité dans ce contexte repose sur trois principales approches [3,4] :
- la chirurgie d’exérèse,
- l’aide médicale à la procréation (AMP), notamment la fécondation in vitro (FIV),
- l’association des deux approches combinées.
Recommandations internationales de prise en charge de l’infertilité [3,4].
Les recommandations Françaises et Européennes de L’ESHRE concernant la prise en charge de l’infertilité associée à l’endométriose profonde soulignent les principes d’une approche individualisée et multidisciplinaire.
Deux grandes lignes se dégagent des données actuelles de la littérature :
- Une personnalisation du traitement : chaque patiente/chaque couple doit être évalué en fonction de son âge, de la réserve ovarienne, de la qualité/quantité embryonnaire présumée, de la qualité spermatique, des antécédents chirurgicaux, de l’extension et la cartographie de l’endométriose profonde, de la balance bénéfice/risque de chaque stratégie, des méthodes antérieures utilisées (insémination, tentative de FIV) et des préférences du couple.
- Une concertation pluridisciplinaire : une étroite collaboration entre chirurgiens, spécialistes et médecins de la reproduction (clinicien et biologiste) apparait dorénavant essentielle pour optimiser le parcours de soins et exposer au couple toutes les alternatives et le niveau de bénéfice/risque attendu au regard des données de la littérature.
Stratégies thérapeutiques : chirurgie et/ou FIV [5].
Le choix formel entre ces stratégies est un sujet débattu dans la littérature internationale mais aussi en pratique clinique, nécessitant une évaluation personnalisée pour chaque patiente. Même si certaines situations imposent une prise en charge en AMP en première ligne dans certains cas, d’autres situations sont plus complexes.
1. Finalité de la chirurgie d’exérèse [6] :
- Objectifs : Restaurer une anatomie pelvienne normale, réduire l’inflammation locale et permettre une conception spontanée ou améliorer les résultats d’une AMP ultérieure.
- Indications principales : La chirurgie peut être discutée dans les cas d’EP lorsque la conception naturelle peut être privilégiée au prix d’une balance bénéfice/risque acceptable (EP sans atteinte digestive). Elle peut être formelle dans certains cas spécifiques comme les douleurs pelviennes sévères et invalidantes ou les lésions obstructives d’organes (urinaires ou digestives). Le traitement des endométriomes gênant la ponction ovocytaire pourra également être discuté au cas par cas (fenestration par coelioscopie, ponction-drainage ou alcoolisation). La kystectomie n’est pas recommandée devant le risque important d’altération de la réserve ovarienne et de récidive. La chirurgie est indiscutable pour favoriser les résultats de la FIV en cas d’hydrosalpinx uni ou bilatéral.
- Limites : Risques opératoires (complications digestives ou urologiques) [6] et l’impact potentiel sur la réserve ovarienne.
A ce sujet, il convient très schématiquement de distinguer les EP sans et avec atteinte digestive.- En l’absence de lésion digestive, la chirurgie d’exérèse complète peut être privilégiée en première intention chez les femmes âgées de moins de 35 ans et/ou avec une bonne réserve ovarienne et selon leur choix pour optimiser les chances de conception naturelle mais aussi les résultats de FIV [7,8,9,10].
- En cas d’atteinte digestive, la problématique principale est celle de la balance bénéfices/risques qui doit être bien explicitée en tenant compte des paramètres précédemment cités mais aussi de l’extension des lésions digestives, de la nature du geste de résection envisagé (résection discoïde ou segmentaire), du nombre de localisations profondes associées (paramètres, vessie, annexes), de la présence d’autres anomalies (adénomyose, myome utérin) et de la voie d’abord utilisée (chirurgie laparoscopique/robotique) [10,11]. C’est l’enjeu des RCP et de la collaboration pluridisciplinaire de valider ces indications complexes.
De nouveau schématiquement, en cas de résection discoïde, le risque chirurgical est faible et permet l’optimisation des chances de conception rapportée par les équipes les plus expertes sur le sujet. En cas de geste segmentaire, le cas par cas doit être priorisé et bien souvent en complémentarité des deux techniques.
2. Finalité de l’Aide médicale à la procréation (AMP) :
- Objectifs : Contourner les obstacles anatomiques, optimiser les chances de conception grâce à des techniques comme la FIV ou l’ICSI et préserver la fertilité par la congélation de gamètes.
- Indications principales : L’AMP pourra être envisagée en première intention lorsque la femme est âgée de plus de 35 ans, en cas de baisse de la réserve ovarienne ou en présence d’autres facteurs d’infertilité (anomalie tubaire ou spermatique associée) [3].
En cas de chirurgie envisagée en première intention, pour anticiper le risque de baisse de réserve ovarienne (geste chirurgical ou délai à l’initiation de la prise en charge en AMP) surtout en cas d’atteinte ovarienne de l'endométriose, une congélation ovocytaire ou embryonnaire pourra être proposée avant [14].
- Limites : Outre les complications propres à la stimulation ovarienne (risque thrombo-embolique et syndrome d’hyperstimulation ovarienne) et à la ponction ovocytaire (infectieux, hémopéritoine, plaie d’organe de voisinage), la présence d’EP favorise le risque d’abcès tubo-ovarien. L’antibioprophylaxie recommandée de manière systématique en cas d’EP permet de limiter ce risque [3].
Contrairement à la chirurgie, l’AMP n’a pas d’efficacité sur les douleurs, cependant le risque d’aggravation des lésions ou de l’évolution de la maladie endométriosique liée à la stimulation ovarienne est minime selon les données actuelles [15].
La chirurgie d’exérèse des lésions d’EP et l’AMP restent complémentaires même en cas de FIV première, la chirurgie pourra être à nouveau discutée en 2ème intention en cas d’échecs répétés de transferts embryonnaires pour favoriser les chances d’implantation.
Comparaison des deux stratégies [5]
Nous proposons les tableaux 1 et 2 pour illustrer les déterminants de la réflexion en RCP.
Tableau 1 : Synthèse des principaux arguments en faveur des deux techniques en cas d’endométriose profonde.
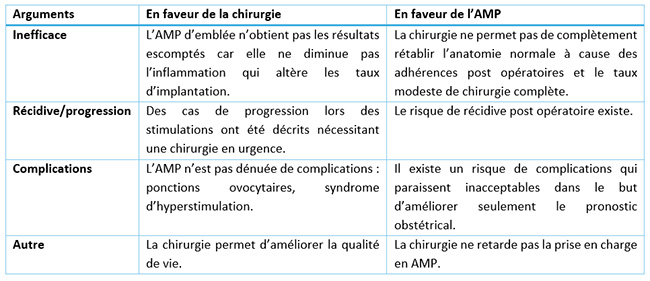
Tableau 2 : Synthèse sur les taux de grossesses et de naissances selon les deux stratégies en distinguant l’infertilité associée à une endométriose profonde sans ou avec atteinte digestive, selon les données de la littérature.
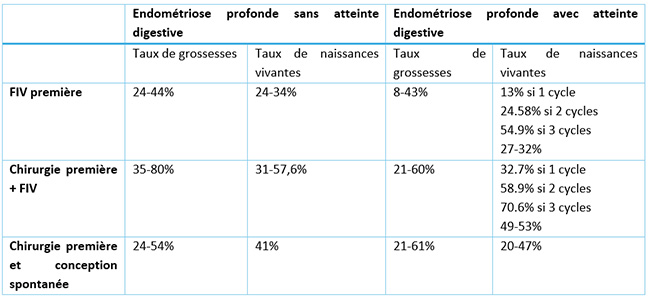
Enfin, les résultats [10,11] des deux plus récentes méta analyses sur le sujet bien que contradictoires mettent en lumière les avantages et limites respectifs des approches chirurgicales et de l'AMP dans le traitement de l'infertilité liée à l'endométriose profonde. Elles soulignent également l'importance d'une prise en charge personnalisée et multidisciplinaire.
Conclusion :
La prise en charge de l’infertilité dans le cadre de l’endométriose profonde reste complexe. La décision entre chirurgie et AMP doit être guidée par une évaluation personnalisée prenant en compte les caractéristiques cliniques spécifiques de chaque patiente.
Dans certains cas, une combinaison des deux stratégies peut offrir les meilleures chances de succès.
Toutefois, un consensus clair basé sur des études robustes manque encore pour orienter systématiquement les praticiens dans leur prise en charge. Le choix entre une chirurgie et/ou une FIV doit être également considéré et discuté avec le couple ou la patiente.
Bibliographie :
- WHO. (2023). Infertility prevalence estimates, 1990–2021: A systematic review and meta-analysis. Geneva: World Health Organization.
- Tang, Q., Pan, F., Yang, J., et al. (2024). Decoding the Epigenetics of Infertility: Mechanisms, Environmental Influences, and Therapeutic Strategies. Epigenomes, 8(3),
- ESHRE Guideline Development Group. (2022). Endometriosis: Diagnosis and Management. European Society of Human Reproduction and Embryology (ESHRE).
- Haute Autorité de Santé (HAS). (2017). Prise en charge diagnostique et thérapeutique de l'endométriose. HAS Guidelines.
Zone d'insertion : Partie sur les recommandations françaises et la prise en charge multidisciplinaire - Owen C, Boujenah J, Cohen J, Puchar A, Vésale E, Goldstein R, Benoit L, d’Argent EM, Daraï É, Bendifallah S. Impact de l’endométriose profonde sur la fertilité : indications respectives de la chirurgie et de l’aide médicale à la procréation. Médecine de la Reproduction 2020 ; 22 (2) : 174-183. doi : 10.1684/mte.2020.0795
- Bendifallah, S., Puchar, A., Vesale, E., et al. (2020). Surgical outcomes after colorectal surgery for endometriosis: A systematic review and meta-analysis. Journal of Minimally Invasive Gynecology, 27(4), 856-867.
- Adamson, G. D., & Pasta, D. J. (2010). Endometriosis Fertility Index: The New, Validated Endometriosis Staging System. Fertility and Sterility, 94(5), 1609-1615.
- Boujenah, J., et al. (2017). Use of the Endometriosis Fertility Index in Daily Practice. European Journal of Obstetrics & Gynecology and Reproductive Biology, 214, 67-71.
- Vesali, S., et al. (2020). Endometriosis Fertility Index for Predicting Non-Assisted Reproductive Technology Pregnancy After Endometriosis Surgery: A Systematic Review and Meta-Analysis. BJOG, 127(7), 800-809.
- Ferrier, C et al. (2015). Impact of deep endometriosis on fertility outcomes: A systematic review. Human Reproduction Update, 21(4), 441-452.
- Bendifallah, S., et al. (2017). Colorectal endometriosis-associated infertility: Should surgery precede ART? Fertility and Sterility, 108(3), 525-531.
- Bourdon, M., Peigné, M., Maignien, C. et al. Impact of Endometriosis Surgery on In Vitro Fertilization/Intracytoplasmic Sperm Injection Outcomes: a Systematic Review and Meta-analysis. Reprod. Sci. 31, 1431–1455 (2024). https://doi.org/10.1007/s43032-023-01421-7
- Liang, Y., Liu, M., Zhang, J., & Mao, Z. (2024). First-line surgery versus first-line assisted reproductive technology for women with deep infiltrating endometriosis: A systematic review and meta-analysis. Frontiers in Endocrinology.
- Santulli P, Bourdon M et al. (2021). Fertility preservation for patients affected by endometriosis should ideally be carried out before surgery. Reprod Biomed Online. 2021 Nov;43(5):853–63.
- Somigliana E, et al. (2019). Ovarian stimulation and endometriosis progression or recurrence: a systematic review. Reprod Biomed Online. 2019 Feb;38(2):185–94.




