L’Infertilité est un problème majeur de santé publique car elle concerne ~15% couples concernés en France. Environ 7% de la pop générale masculine est infertile et 50% des infertilités dont d’origine masculine.
Les étiologies génétiques masculines : il existe actuellement 2300 gènes impliqués dans la spermatogenèse (Gibson, 2010). Le diagnostic d’une origine génétique à l’infertilité est positif dans 15-20% des cas (Krausz, 2011; Krausz et al, 2014) mais ~40% restent « idiopathiques » post-screening. De nouveaux tests génétiques sont en cours de développement comme l’épigénétique des spermatozoïdes, la découverte de nouveaux SNPs, CNVs.. : de nouveaux marqueurs vont émerger dans les années à venir.
Nous allons présenter dans un 1er temps un rappel sur les principales origines génétiques des infertilités masculines puis des cas cliniques avant de conclure sur la place de ces analyses dans le diagnostic.
1/ Principales origines génétiques des infertilités masculines
Nous distinguons les anomalies chromosomiques des anomalies moléculaires portant sur l’ADN.
Les anomalies chromosomiques représentent 6~7% des infertilités masculines (Gekas et al,2001). Il peut s’agir d’anomalie de nombre des chromosomes, en particulier des gonosomes (chromosomes sexuels) comme le Syndrome de Klinefelter (47,XXY) ou de structure pouvant concerner aussi bien les gonosomes que les autres chromosomes et qui sont à l’origine de 13% des infertilités avec anomalies sévères du spermogramme (ex : anneau de l’Y, translocation (X ;Y) ou les translocations robertsoniennes (ex : rob(13 ;14) ou réciproques (tous les chromosomes peuvent être impliqués).
Les anomalies moléculaires touchant l’ADN représentent 15~20% des infertilités masculines (Repping et al,2003; Vogt, 2005; Carvalho et al,2006; Viswambharan et al,2007 ). Nous retrouvons parmi les plus fréquentes les microdélétions de l’Y retrouvéesd dans 10% azoo NO et 5% OATS, les mutations du gène CFTR très fréquentes dans la population générale mais difficiles à ciblre puisqu’il existe à l’heure actuelle plus de 850 variants repertoriés, les variants épigénétiques et les mutations du gène AR (recepteur des Androgènes).
2/ Cas cliniques
Cas n°1 : Mr TD: 28 ans. Bilan d’une azoospermie. Bilan Hormonal: augmentation isolée FSH
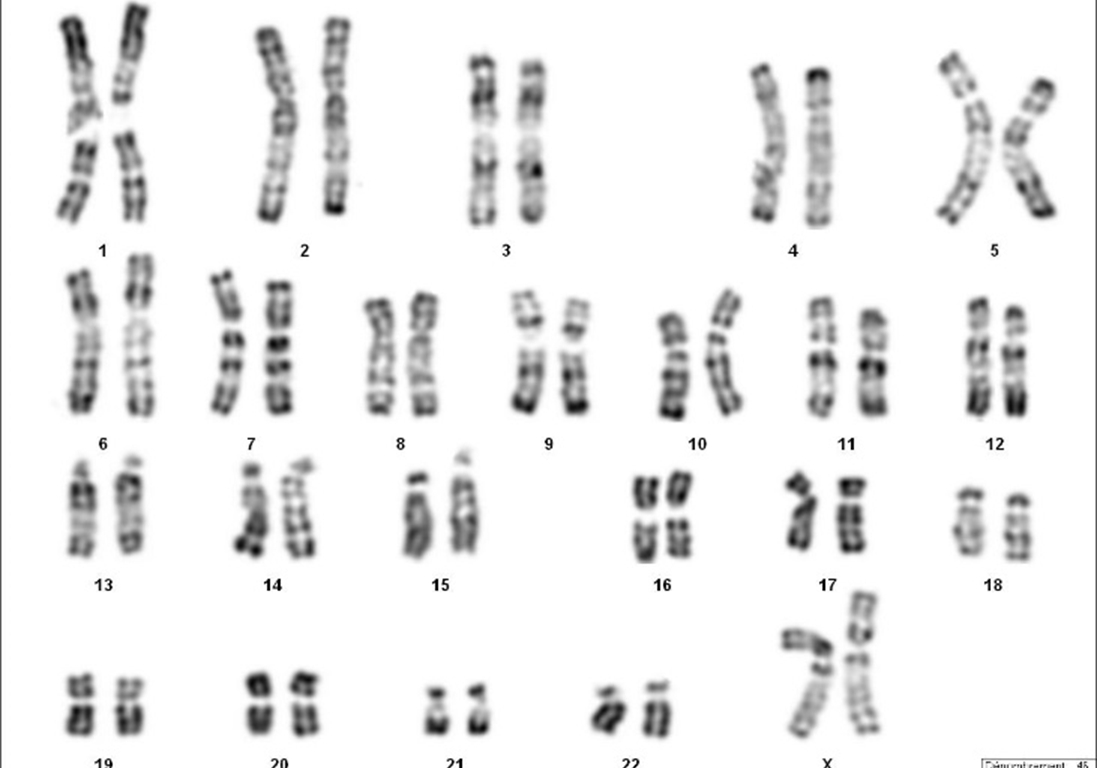
Caryotype sanguin : 46,XX
Recherche de microdélétion de l’Y: AUCUNE amplification, absence des régions AZF et de SRY.
Examens complémentaires réalisés : analyse FISH metaphasique pour recherche du locus SRY :
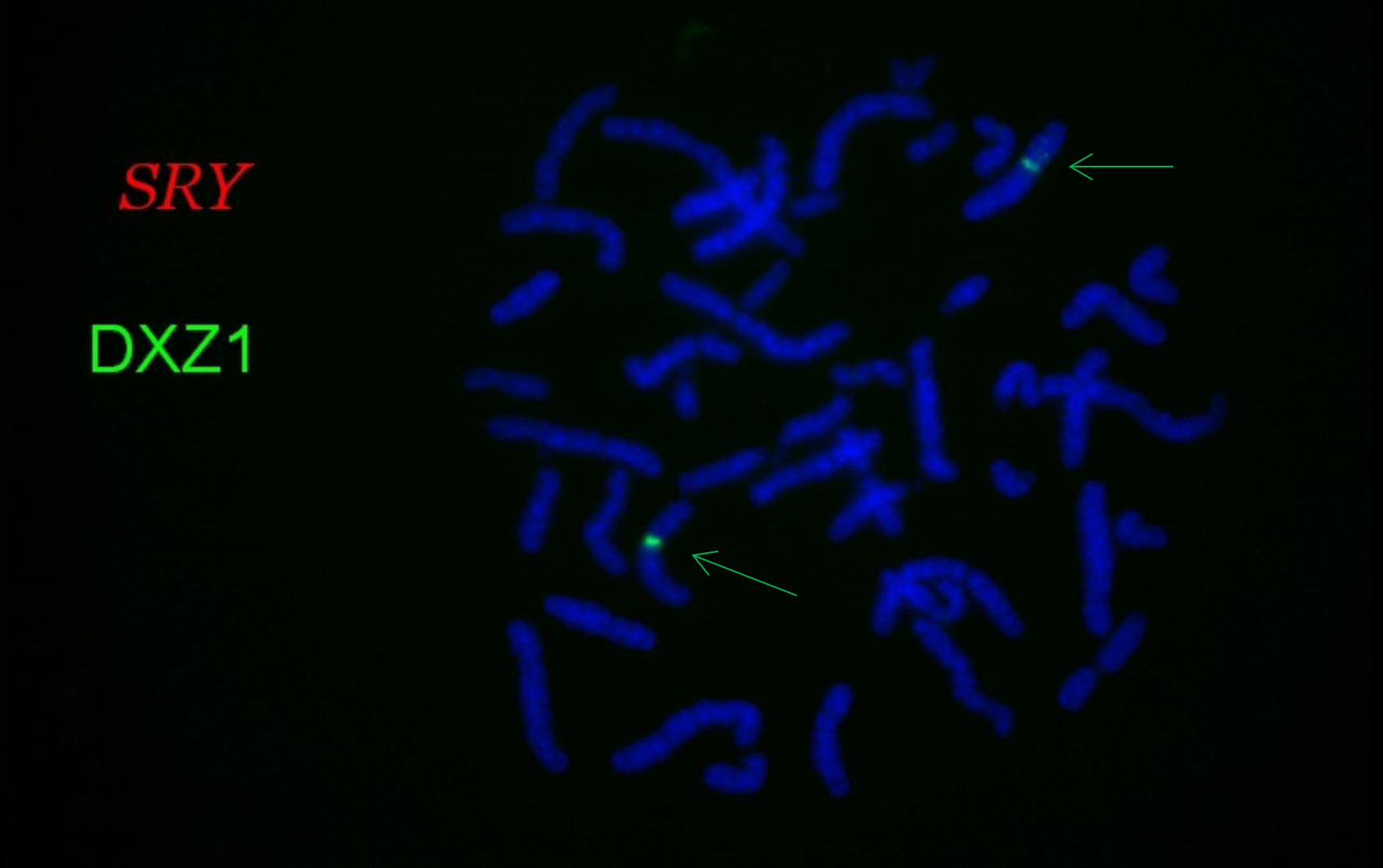
Présence de 2 centromères de l’X (vert) et ABSENCE de SRY en Yp11.31 (rouge)
Discussion : l’absence de SRY serait à l’origine d’une azoospermie. Or le patient présente caractères sexuels secondaires masculins -> autres gènes fonctionnels sur des autosomes (SOX3, SYCP3,USP9Y…) : nécessiterait un séquençage complet de ces gènes mais ne se fait pas en routine
CAT : Le patient doit être vu en Conseil Génétique au cours duquel le don de sperme sera évoqué et une enquête familiale doit être réalisée
Cas n°2 : Mr PT: 46 ans. Suspicion d’un Syndrome de Klinefelter sur bilan endocrinologique.
Caryotype sanguin: présence d’une mosaïque avec 3 populations cellulaires différentes
mos 46,XX[2]/46,XY[2]/47,XXY[46]
Réalisation d’une FISH interphasique: mosaïque retrouvée avec 96% de lignée XXY : mos 46,XX[2]/46,XY[2]/47,XXY[46].nuc ish(DXZ1x2)[1]/(DXZ1,DYZ3)x1[3]/(DXZ1x2,DYZ3x1)[96]
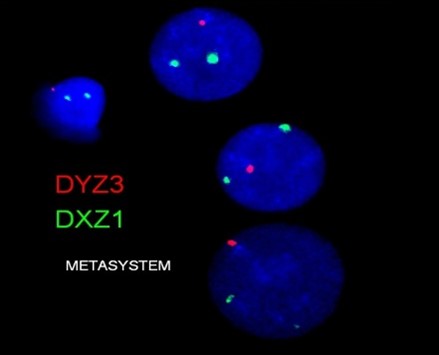
- Discussion: Présence d’une mosaïque avec une lignée majoritaire à 47,XXY responsable du phénotype KS et d’une azoospermie MAIS présence d’une lignée XY minoritaire: il existe donc une possibilité spermatogenèse résiduelle. Cependant, la présence de cette anomalie laisse un risque d’anomalie des gonosomes 1% dans les spermatogenèse.
- CAT: Le conseil génétique est indispensable. Une chirurgie testiculaire (BT) peut être envisagée si réalisable pour récupérer des spermatozoïdes. La nécessité d’un Diagnostic prénatal est à discuter en raison du pourcentage faible mais présent du risque d’anomalie de nombre des gonosomes chez le fœtus. Il n’y a aucune indication à faire un DPI.
3/ Conclusion
L’Infertilité masculine est une maladie multifactorielle complexe et un vrai problème de santé publique. Une identification précise du trouble de la spermatogenèse permet de mieux cibler les anomalies à rechercher (chromosomique ou moléculaire). La FISH sur sperme est peu utilisée en routine mais peut agir en tant qu’outil décisionnel selon les cas. Elle peut être classique (chromosomes 13,18,21,X et Y) ou spécifique selon les chromosomes impliqués dans le remaniement présent sur le caryotype, en permettant d’avoir un reflet de la meiose spermatique à un instant T mais représentatif de la spermatogenèse générale du patient. Grâce au séquençage complet du génome, de nouveaux gènes, SNPs, variants sont mis en évidence et pourraient être à l’origine des troubles mais restent à confirmer (progrès de la recherche / interprétation complexe). A l’heure actuelle, plus de 2000 gènes sont connus et interviennent dans la spermatogenèse : ATTENTION, un gène peut en cacher un autre ! Les facteurs épigénétiques représentent également de nouvelles pistes…
Dans tous les bilans, ne pas oublier d’explorer la conjointe !!
Dr Valérie KOUBI, médecin généticien, Laboratoire Eylau Unilabs, Neuilly-sur-Seine



