La chirurgie axillaire, dans le cancer du sein, a vu au cours de ces vingt dernières années, des changements de prise en charge considérables. Tout d’abord, d’un point de vue technique, vers la fin des années 1990, l’apparition de la procédure du ganglion sentinelle. Ensuite, d’un point de vue logistique, avec l’apparition de nouvelles méthodes de détection et l’utilisation de moins en moins fréquente de l’examen histologique extemporané. Puis, récemment, l’apparition de procédures permettant de cibler plus précisément les ganglions axillaires à réséquer. C’est également l’indication de plus en plus fréquente des thérapies systémiques néo-adjuvantes (CNA), qui a, récemment, fait modifier la prise en charge chirurgicale du creux axillaire.
Jusque dans les années 1990, le gold standard de la chirurgie axillaire était le curage axillaire des niveaux I, II et III de Berg. Cette procédure permettait, grâce à l’évidemment cellulo- ganglionnaire axillaire, d’obtenir une information pronostique, d’être thérapeutique, en diminuant le volume tumoral pour faciliter l’effet de la radiothérapie, et de prévoir, dans les cas d’atteinte ganglionnaire, un traitement adjuvant[1,2]. L’inconvénient de cette technique est sa complication majeure, qui est le lymphoedème du membre supérieur et le handicap fonctionnel associé. Cette complication survient dans plus de 10% à 30% des cas. D’autres complications comme des paresthésies ou d’autres troubles sensitivo-moteurs du membre supérieur peuvent survenir, soit en association avec le lymphoedème ou de façon isolée. Les données ayant motivé les cliniciens à chercher et à trouver une nouvelle procédure axillaire, moins morbide, était le fait que pour les tumeurs de petite taille (T1 et T2), l’atteinte ganglionnaire axillaire n’était présente que dans 30% des curages axillaires[3,4]. Autrement dit, 70% des curages axillaires étaient superflus. Lorsque la procédure du ganglion sentinelle axillaire a été décrite[3], et adoptée assez rapidement par toute la communauté sénologique, elle a permis de limiter le nombre de curages axillaires, et concomitamment, de diminuer le lymphoedème du membre supérieur.
La procédure du ganglion sentinelle axillaire consiste à détecter et à réséquer le premier, ou les deux à trois premiers ganglions de la chaîne lymphatique axillaire drainant le sein. La détection peut se faire soit par méthode radio-isotopique (injection de 99mTc), soit par méthode colorimétrique (injection de bleu patenté), soit par méthode fluorescente (injection de vert d’indocianine). La dissection axillaire permettant la résection des ganglions sentinelles est beaucoup moins importante que pour celle d’un curage axillaire. C’est cette dissection a minima qui explique le taux plus faible de complications post opératoires.
Lors des premiers protocoles mise en place, l’examen histologique extemporané permettait de détecter une atteinte ganglionnaire pendant l’intervention et compléter le geste axillaire par un curage axillaire. Dans les cas où l’examen extemporané était négatif, mais le définitif positif (c'est-à-dire constatant la présence de métastases ganglionnaires), une deuxième intervention était indiquée, pour compléter le geste axillaire. L’examen histologique extemporané est de moins en moins indiqué lors de la procédure du ganglion sentinelle axillaire. Et dans les cas où, à l’examen histologique définitif, l’un des ganglions est positif, la reprise chirurgicale axillaire n’est plus systématique. Dans la plupart de ces cas, la radiothérapie des aires ganglionnaires va venir compléter le traitement axillaire.
C’est à la suite de l’étude prospective multicentrique et randomisée, menée par l’Association Américaine de Chirurgiens Oncologiques (ACOSOG) Z0011[5,6], que la prise en charge axillaire, en cas d’atteinte ganglionnaire, a changé. Le but de cette étude était de déterminer l’effet du curage sur la survie globale, chez des patientes présentant une métastase ganglionnaire. La conclusion de cette étude, à dix ans, était que le curage axillaire n’affecte pas la survie globale ou la survie sans récidive, chez des patientes T1-T2, avec un ou deux ganglions sentinelles positifs. D’autres études sont venues depuis confirmer cette hypothèse[7].
Les traitements néo adjuvants et leur indication de plus en plus large, ont également changé l’approche du creux axillaire. Il a clairement été établie que la procédure du ganglion sentinelle axillaire devrait être réalisée après le traitement néo-adjuvant, et non pas avant[8]. Les inconvénients majeurs de la réalisation du SLND avant la CNA, sont le fait d’effectuer deux procédures chirurgicales séparées, avec une diminution concommitante de la fiabilité de cette deuxième intervention[9,10], ainsi que la prolongation du délai avant le début de la CNA pour permettre la cicatrisation. La réalisation du SLND avant la CNA empêche la possibilité d’éviter un curage chez les patientes présentant une réponse pathologique complète[8]. Il a également été démontré que la maladie résiduelle, dans le sein et en axillaire, après une CNA, est un facteur prédictif de récidive locorégionale plus important que le status ganglionnaire pré CNA[10]. Il a été démontré, lors de chirurgie conservatrice du sein, chez les patientes initialement cN0, que le risque de récidive locorégional, à 10 ans et après CNA est ≤2%, quelque soit le résultat histologique final. Par contre, chez les patientes initialement cN+, le risque de récidive locorégionale dépend du résultat histologique final (≤2% et 8 à 9% en cas de réponse pathologique complète et réponse pathologique incomplète, respectivement). En cas de mastectomie après CNA, l’absence de réponse pathologique complète ganglionnaire est un facteur prédictif majeur de récurrence locorégionale à 10 ans (HR à 4.5)[11].
Puis, révolution récente, l’étude Z1071, menée par l’ACOSOG[12], a permis de définir un taux de faux négatif, après procédure du ganglion sentinelle post chimiothérapie néo-adjuvante de 12.6%. Ce taux brut est supérieur au taux définit comme acceptable, par les auteurs (<10%). Les auteurs se sont ensuite intéressés aux facteurs pouvant modifier ce taux et ils trouvent qu’à partir de 3 ganglions sentinelles négatifs, détectés par une double méthode (radio-isotopique et colorimétrique), le taux de faux négatif devient « acceptable ». (tableaux 1 et 2).
Dans un sous-groupe de la population étudiée dans Z1071, certaines techniques de détection du ganglion atteint permettent de diminuer le taux de faux négatif à 6.8%. Ceci est le cas si en pré chimiothérapie néo- adjuvante, le ou les ganglions positifs (détectés par échographie axillaire et confirmés par la biopsie ganglionnaire) sont marqués par un clip métallique, puis repérés et réséqués en même temps que la procédure du ganglion sentinelle. En utilisant ces techniques de chirurgie ciblée, et avec ce taux acceptable de faux négatifs, le curage axillaire peut être évité dans 47% des cas, après CNA[12].
Certaines équipes ce sont intéressés à ces nouvelles techniques de chirurgie axillaire ciblée (targeted axillary dissection, TAD). Par exemple, Caudle et al.[13] démontre que le status du ganglion clippé et prédictif du status ganglionnaire des ganglions restants dans le creux axillaire. Il trouve dans son étude un taux de faux négatif de 4.2%, et ce taux diminue à 2% lorsque la TAS est associée à la procédure du ganglion sentinelle. D’autres équipes[14,15] trouvent des résultats similaires, avec l’utilisation d’un marqueur ganglionnaire radioactif (clip marqué à l’125I), et un taux de faux négatif de 7%, lorsque cette technique est utilisée seule. (tableau 3)
L’un des problèmes posés par ces nouvelles méthodes est l’utilisation de matériel radioactif, lorsque celui-ci doit être placé en début de traitement néo-adjuvant. Leur utilisation semble sécure, mais d’autres études seront nécessaires pour valider ces procédures. Des alternatives pour la détection et localisation des ganglions à réséquer existent et sont en cours d’évaluation (localisation à l’aide de fils métalliques ; tatouage à l’encre ; identification par un marqueur à radio-fréquence ; marqueur à l’oxide de fer super-paramagnetique).
Conclusion
La procédure du ganglion sentinelle axillaire a supplanté le curage axillaire, qui garde des indications de moins en moins fréquentes. Le développement de la radiothérapie adjuvante et des thérapeutiques systémiques néoadjuvantes ont permis d’affiner l’approche du creux axillaire et de complexifier la logistique.
Tableau 1. Etudes évaluant les taux d’identification du ganglion sentinelle et de faux négatifs, chez des patientes cN+, bénéficiant de la procédure du ganglion sentinelle, après une chimiothérapie néo-adjuvante

Abréviations : SENTINA – sentinel Neoadjuvant ; ACOSOG – American College of Surgeons Oncology Group; SN FNAC – Sentinel Node
Biopsy Following Neoadjuvant Chemotherapy ; IR – identification rate ; FNR – false negative rate.
Tableau 2. Facteurs modifiant les taux d’identification du ganglion sentinelle et de faux négatifs, dans les études SENTINA, ACOSOG Z1071 et SN FNAC
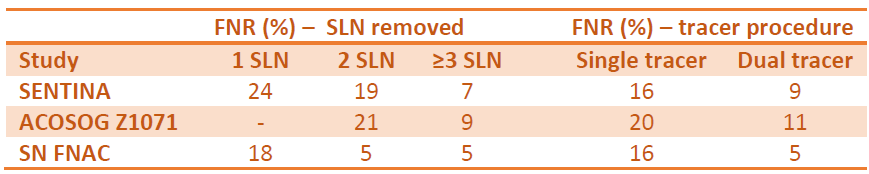
Abréviations : SLN – ganglion sentinelle
Tableau 3. Etudes évaluant les taux d’identification du ganglion sentinelle et de faux négatifs, en utilisant des techniques de dissection axillaire ciblée, après CNA.

Abréviations : MARI procedure – résection d’un ganglion positif, marqué par un traceur radioactif ( 125I) avant la CNA ; TAD (Caudler et al.étude monocentrique)– chirurgie axillaire ciblée : association de la procédure du ganglion sentinelle et de la résection du ganglion positif,
clippé en pré CNA, puis marqué par un traceur radioactif (125I) en fin de CNA ; RISAS (étude en cours, multicentrique et prospective) – association de la procédure du ganglion sentinelle et de la résection du ganglion positif, marqué par un traceur radioactif (125I) avant la CNA.
Bibliographie
|
1. |
Halsted WS. A Clinical and Histological Study of certain Adenocarcinomata of the Breast: and a Brief Consideration of the Supraclavicular Operation and of the Results of Operations for Cancer of the Breast fro m 1889 to 1898 at the Johns Hopkins Hospital. Ann Surg. 1898 Nov;28(5):557-76. |
|
2. |
Halsted WS. The Results of Radical Operations for the Cure of Carcinoma of the Breast. Ann Surg. 1907 Jul;46(1):1-19. |
|
3. |
Giuliano AE, Haigh PI, Brennan MB, Hansen NM, Kelley MC, Ye W, Glass EC, Turner RR. Prospective observational study of sentinel |
|
4. |
Veronesi U, Paganelli G, Viale G, Luini A, Zurrida S, Galimberti V, Intra M, Veronesi P, Robertson C, Maisonneuve P, Renne G, De |
|
5. |
Giuliano AE, Hunt KK, Ballman KV, et al.Axillary dissection vs no axillary dissection in women with invasive breast cancer and |
|
6. |
Giuliano AE, McCall L, Beitsch P, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary |
|
7. |
Donker M, van Tienhoven G, Straver ME, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer |
|
8. |
Pielewski M, Morrow M. Axillary Nodal Management Following Neoadjuvant Chemotherapy: A Review. JAMA Oncol. 2017 Apr |
|
9. |
T. Kuehn, I. Bauerfeind, T. Fehm, et al.Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant |
|
10. |
A.E. Giuliano, L. McCall, P. Beitsch, et al.Locoregional recurrence after sentinel lymph node dissection with or without axillary |
|
11. |
Mamounas EP, Anderson SJ, Dignam JJ, et al. Predictors of locoregional recurrence after neoadjuvant chemotherapy: results fro m |
|
12. |
Boughey JC, Suman VJ, Mittendorf EA, et al; Alliance for Clinical Trials in Oncology. Sentinel lymph node surgery after neoad juvant |
|
13. |
Caudle AS, Yang WT, Krishnamurthy S, et al. Improved axillary evaluation following neoadjuvant therapy for patients with node - |
|
14. |
Donker M, Straver ME, Wesseling J, et al. Marking axillary lymph nodes with radioactive iodine seeds for axillary staging aft er |
|
15. |
van Nijnatten TJA, Simons JM, Smidt ML, et al. A Novel Less-invasive Approach for Axillary Staging After Neoadjuvant |



