Introduction
Depuis l’essor des protocoles antagonistes en FIV, une large place s’est ouverte pour l’utilisation du déclenchement par agoniste. L’agoniste en injection unique a la capacité de déclencher un pic de LH nécessaire au déclenchement de l’ovulation.
Le déclenchement de l’ovulation dans le processus de l’hyperstimulation contrôlée en FIV est une étape cruciale pour la reprise de méiose et l’obtention d’ovocytes matures, seuls capables d’être fécondés.
L’HCG de par son activité LH et sa ½ vie longue est la molécule de référence pour le déclenchement de l’ovulation. Les principales différences entre les deux produits sont : pour l’agoniste une médiation hypophysaire de la décharge de LH mimant la physiologie associée à un pic de FSH avec une ½ vie beaucoup plus courte que le pic physiologique et bien sûr aussi que l’HCG qui a une action directement folliculaire.
La 1ère conséquence d’un déclenchement de l’ovulation par agoniste sans soutien spécifique de la phase lutéale est un raccourcissement de celle-ci et par conséquent une moindre efficacité en terme de grossesse avec une augmentation du taux de fausse-couche.
La 2e conséquence grâce à sa ½ vie courte est une diminution significative du risque d’hyperstimulation ovarienne. (Youssef et al., 2014)
Il est vite apparu à tous, dès lors qu’un des objectifs majeurs de notre activité était de réduire le risque d’hyperstimulation ovarienne .(Devroey et al., 2011) qu’il fallait utiliser ce type de déclenchement lorsqu’il n’y avait pas de transfert à prévoir après un cycle de stimulation comme c’est le cas dans la préservation de fertilité et le don d’ovocytes.
Améliore-t’on la qualité ovocytaire en déclenchant avec un agoniste ?
Le pic ovulatoire est plus physiologique avec la présence du pic de FSH associé au pic de LH. La première étude randomisée comparant les deux types de déclenchement dans une population de normo répondeuse retrouvait un meilleur taux de maturité ovocytaire dans le groupe déclenché par agoniste (Humaidan et al., 2010)
Un certain nombre d’études sont publiées sur l’utilisation concommitante d’agoniste et d’HCG pour optimiser le recueil d’ovocytes matures. Il s’agit pour la majorité d’études avec de faibles effectifs et rétrospectives et les résultats sont contradictoires (Mizrachi et al., 2020). Il y a néanmoins une probabilité pour que l’adjonction d’un déclenchement agoniste à L’HCG améliore le recueil d’ovocytes matures dans une population avec faible taux de maturité avec déclenchement par HCG seul (Herbemont et al., 2019)(Ben-Haroush et al., 2019)
Doit-on toujours congeler lorsque l’on déclenche avec un agoniste ?
La réponse serait oui si l’on démontre que le « freeze all » pour tous a une meilleure efficacité que le transfert frais. Dans l’immédiat certains centres et certains pays n’ont pas la possibilité pour des raisons économiques et parfois légales de tout congeler.
Si l’on souhaite faire un transfert frais après un déclenchement agoniste, il faut compenser l’insuffisance lutéale présente dans tous les cycles de stimulation ovarienne mais exacerbée lors d’un déclenchement agoniste du fait de la courte ½ vie du produit.
Le soutien de la phase lutéale se fait selon le modèle américain : adjonction de fortes doses de progestérone IM et d’estrogènes, ou le modèle européen avec adjonction de faible doses d’HCG après la ponction ovocytaire en sus de la progestérone.
Nous appliquons le protocole Européen dans notre centre à chaque fois qu’il existe un risque d’hyperstimulation ovarienne :>de 18 follicules > 11mm le jour du déclenchement. Selon le recueil ovocytaire obtenu après déclenchement agoniste et état de la patiente nous arbitrons vers une injection de 1500UI d’HCG après ponction (<20 ovocytes, patiente non algique et sans épanchement avant début de ponction) et transfert frais, soit vers une congélation totale dans les autres cas. Nous avons ainsi pu mettre en évidence que notre taux de naissance était équivalent à une population appariée déclenchée par HCG avec toutefois une nette réduction des syndromes d’hyperstimulations ovariennes. (Cherrière et al., 2020). Ceci incite à développer le déclenchement agoniste et la recherche vers le meilleur soutien de la phase lutéale : répétition de faibles doses d’HCG ou répétition d’injection d’agoniste ?(Wiser et al., 2019)
Comment s’assurer de l’efficacité du déclenchement agoniste ?
Pour que le déclenchement agoniste soit efficace, il faut que l’hypophyse soit fonctionnelle. Ainsi les situations de déplétion de l’hypophyse comme le cas spécifique de l’aménorrhée hypothalamo-hypophysaire ou les traitements anti gonadotropes prolongés sont des facteurs de risque d’échec. Le taux d’échec est évalué à 2%.
Il semble que l’efficacité du déclenchement soit proportionnel au BMI de la patiente (Lainas et al., 2019).La prise en compte de la LH de base et de la LH de fin de phase folliculaire sont importantes à évaluer, ainsi une LH de base <2 UI/ml expose à un risque de recueil ovocytaire sous optimal.
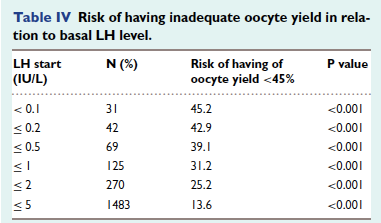
(Popovic-Todorovic et al., 2019)
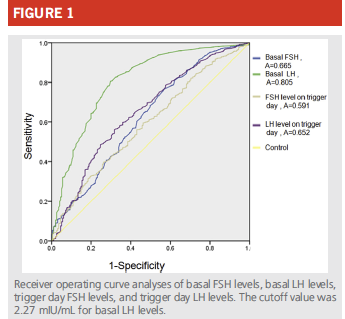
(Lu et al., 2016)
Un taux de LH <0,5 UI/ml au jour du déclenchement expose également à un recueil sous optimal.
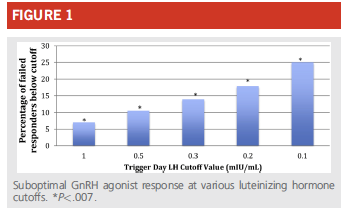
(Meyer et al., 2015)
Une fois le déclenchement réalisé, il est également possible et recommandé d’évaluer l’efficacité du déclenchement. Ainsi une LH > 15, 12 heures après le déclenchement est un argument pour une bonne efficacité du déclenchement.
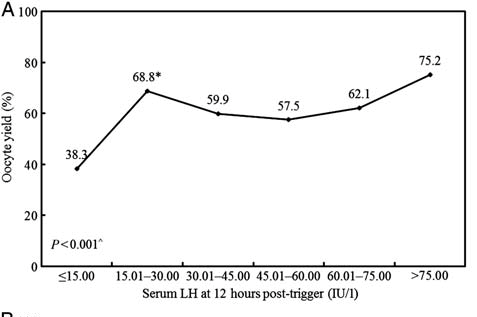
(Chen et al., 2012)
Le dosage de progestérone couplé à la LH semble plus performant ainsi un dosage > 3ng de progestérone et ou une LH > 15 semblent garants de la bonne efficacité du déclenchement agoniste.
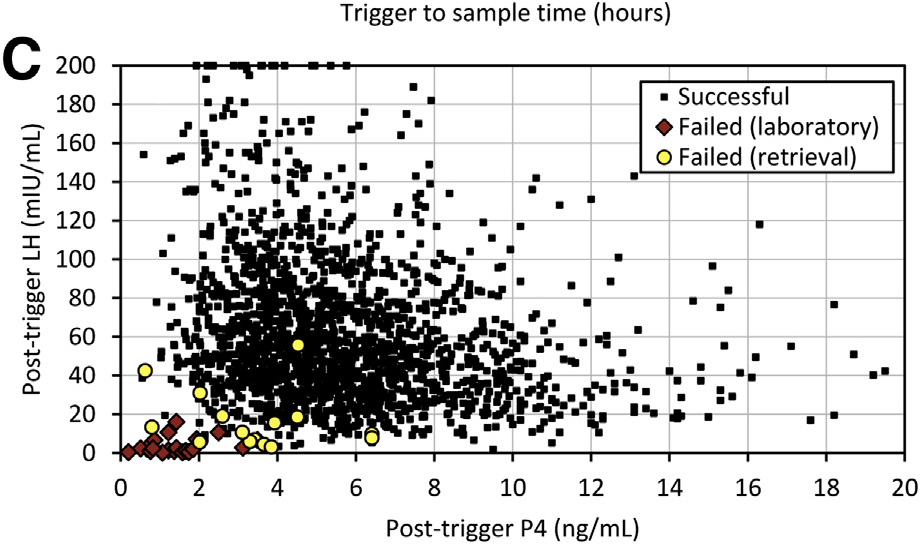
(Chang et al., 2016)
L’intérêt des dosages du lendemain est la possibilité de récupérer le cycle en rédeclenchant le lendemain avec de l’HCG (attention au risque OHSS) et même le surlendemain en cas de mauvais recueil des premiers follicules ponctionnés.
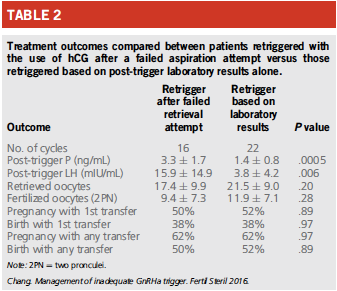
CONCLUSION
Le déclenchement par agoniste offre manifestement plus de confort aux femmes et doit être systématiquement utilisé dans les indications de « freeze all ».
Il est possible que le déclenchement agoniste améliore la maturité ovocytaire s’il existe un défaut de maturation après un déclenchement par agoniste mais les études randomisées sont en cours.
Le transfert frais reste possible après déclenchement par agoniste à condition de renforcer la phase lutéale, là encore des études sont en cours pour définir la meilleure stratégie.
En cas de doute, il est nécessaire de vérifier l’efficacité du déclenchement agoniste par dosage de la LH et Progestérone le lendemain du déclenchement.
Bibliographie
Ben-Haroush, A., Sapir, O., Salman, L., Altman, E., Garor, R., Margalit, T., Shufaro, Y., Oron, G., 2019. Does “Dual Trigger” Increase Oocyte Maturation Rate? J. Obstet. Gynaecol. J. Inst. Obstet. Gynaecol. 1–3. https://doi.org/10.1080/01443615.2019.1674791
Chang, F.E., Beall, S.A., Cox, J.M., Richter, K.S., DeCherney, A.H., Levy, M.J., 2016. Assessing the adequacy of gonadotropin-releasing hormone agonist leuprolide to trigger oocyte maturation and management of inadequate response. Fertil. Steril. 106, 1093-1100.e3. https://doi.org/10.1016/j.fertnstert.2016.06.013
Chen, S.-L., Ye, D.-S., Chen, X., Yang, X.-H., Zheng, H.-Y., Tang, Y., He, Y.-X., Guo, W., 2012. Circulating luteinizing hormone level after triggering oocyte maturation with GnRH agonist may predict oocyte yield in flexible GnRH antagonist protocol. Hum. Reprod. Oxf. Engl. 27, 1351–1356. https://doi.org/10.1093/humrep/des049
Cherrière, F., Arvis, P., Le Pabic, E., Bidet, M., Jaffré, F., Guivarc’h-Levêque, A., 2020. Equivalent live-birth rate in antagonist IVF/ICSI protocol after oocyte triggering with GnRH agonist supplemented with 1500 r-hCG the day of oocyte retrieval vs r-hCG : A case-control study. J. Gynecol. Obstet. Hum. Reprod. 101702. https://doi.org/10.1016/j.jogoh.2020.101702
Devroey, P., Polyzos, N.P., Blockeel, C., 2011. An OHSS-Free Clinic by segmentation of IVF treatment. Hum. Reprod. Oxf. Engl. 26, 2593–2597. https://doi.org/10.1093/humrep/der251
Herbemont, C., El Kouhen, I., Brax, A., Vinolas, C., Dagher-Hayeck, B., Comtet, M., Calvo, J., Sarandi, S., Grynberg, M., Cédrin-Durnerin, I., Sifer, C., 2019. [Dual trigger with gonadotropin-releasing hormone agonist and hCG to improve oocyte maturation rate]. Gynecol. Obstet. Fertil. Senol. 47, 568–573. https://doi.org/10.1016/j.gofs.2019.06.012
Humaidan, P., Ejdrup Bredkjaer, H., Westergaard, L.G., Yding Andersen, C., 2010. 1,500 IU human chorionic gonadotropin administered at oocyte retrieval rescues the luteal phase when gonadotropin-releasing hormone agonist is used for ovulation induction: a prospective, randomized, controlled study. Fertil. Steril. 93, 847–854. https://doi.org/10.1016/j.fertnstert.2008.12.042
Lainas, G.T., Lainas, T.G., Sfontouris, I.A., Venetis, C.A., Bosdou, J.K., Chatzimeletiou, A., Grimbizis, G.F., Tarlatzis, B.C., Kolibianakis, E.M., 2019. Association between body mass index and oocyte maturation in patients triggered with GnRH agonist who are at high risk for severe ovarian hyperstimulation syndrome: an observational cohort study. Reprod. Biomed. Online. https://doi.org/10.1016/j.rbmo.2019.10.006
Lu, X., Hong, Q., Sun, L., Chen, Q., Fu, Y., Ai, A., Lyu, Q., Kuang, Y., 2016. Dual trigger for final oocyte maturation improves the oocyte retrieval rate of suboptimal responders to gonadotropin-releasing hormone agonist. Fertil. Steril. 106, 1356–1362. https://doi.org/10.1016/j.fertnstert.2016.07.1068
Meyer, L., Murphy, L.A., Gumer, A., Reichman, D.E., Rosenwaks, Z., Cholst, I.N., 2015. Risk factors for a suboptimal response to gonadotropin-releasing hormone agonist trigger during in vitro fertilization cycles. Fertil. Steril. 104, 637–642. https://doi.org/10.1016/j.fertnstert.2015.06.011
Mizrachi, Y., Horowitz, E., Farhi, J., Raziel, A., Weissman, A., 2020. Ovarian stimulation for freeze-all IVF cycles: a systematic review. Hum. Reprod. Update 26, 118–135. https://doi.org/10.1093/humupd/dmz037
Popovic-Todorovic, B., Santos-Ribeiro, S., Drakopoulos, P., De Vos, M., Racca, A., Mackens, S., Thorrez, Y., Verheyen, G., Tournaye, H., Quintero, L., Blockeel, C., 2019. Predicting suboptimal oocyte yield following GnRH agonist trigger by measuring serum LH at the start of ovarian stimulation. Hum. Reprod. Oxf. Engl. 34, 2027–2035. https://doi.org/10.1093/humrep/dez132
Wiser, A., Klement, A.H., Shavit, T., Berkovitz, A., Koren, R.R., Gonen, O., Amichay, K., Shulman, A., 2019. Repeated GnRH agonist doses for luteal support: a proof of concept. Reprod. Biomed. Online 39, 770–776. https://doi.org/10.1016/j.rbmo.2019.07.031
Youssef, M.A.F.M., Van der Veen, F., Al-Inany, H.G., Mochtar, M.H., Griesinger, G., Nagi Mohesen, M., Aboulfoutouh, I., van Wely, M., 2014. Gonadotropin-releasing hormone agonist versus HCG for oocyte triggering in antagonist-assisted reproductive technology. Cochrane Database Syst. Rev. CD008046. https://doi.org/10.1002/14651858.CD008046.pub4



