Yves VILLE 1,2 et Marianne LERUEZ 1,3
1EHU PACT : Prise en charge des anomalies congénitale et leur traitement, 2. Maternité et service de médecine et chirurgie fœtale, 3. Laboratoire national de référence herpès virus. Hôpital Necker Enfants Malades, Université de Paris.
L’infection congénitale au CMV (VCM) touche 0,7 % de tous les nouveau-nés dans le monde (1) et 15 à 20 % en développent des séquelles à long terme (2). Dans les pays à haut revenu, environ la moitié des nouveau-nés infectés le sont à la suite d’une infection maternelle primaire et l’autre moitié suivant une infection maternelle non primaire (réactivation ou réinfection) (3,4). Il a été récemment montré, qu’après une infection primaire maternelle, seules celles du premier trimestre peuvent être sources de séquelles (5-7). Dans l’histoire naturelle de l’infection, environ 30 à 35 % des nouveau-nés infectés après une infection du premier trimestre développent des séquelles neurologiques et 25 % souffrent d’une perte auditive, unilatérale dans 2 tiers des cas (8). Malgré le lourd fardeau de l’infection congénitale à CMV, le dépistage de l’infection primaire pendant la grossesse n’a pas été recommandé par les organismes de santé publique jusqu’à présent (9,10) et encore tout récemment par le Haut conseil de Santé Publique en France fin 2018 (11).
Cela est dû aux préoccupations concernant l’épidémiologie, la sensibilité et la spécificité des tests sérologiques, la difficulté d’établir le pronostic d’un fœtus infecté et l’absence d’options thérapeutiques validées.
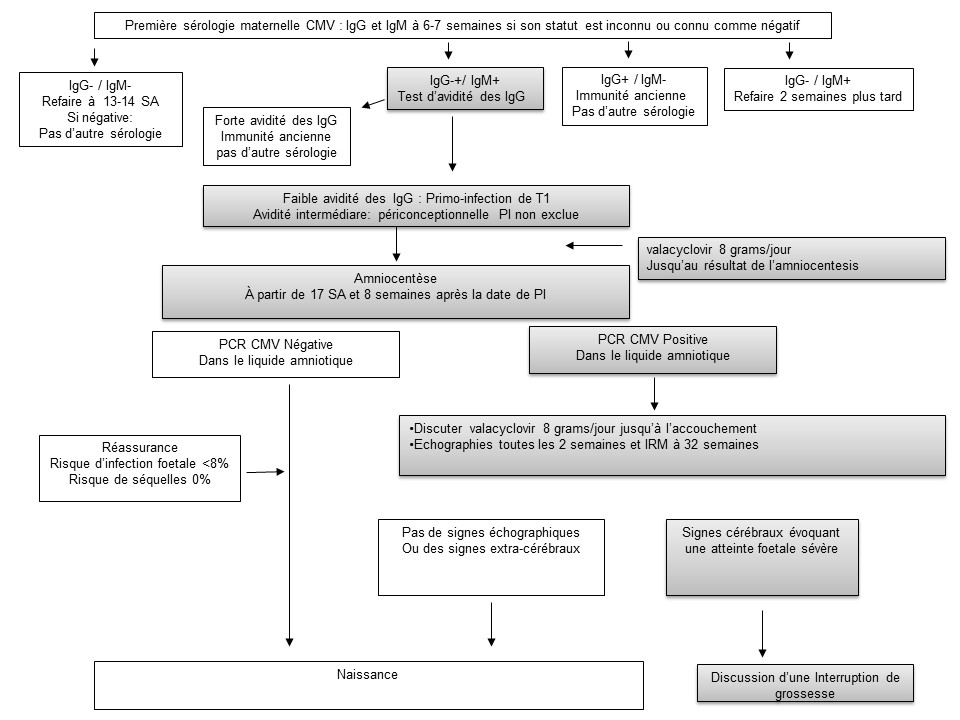
L’objectif de cet éditorial est d’examiner si suffisamment de progrès ont été réalisés au cours des dernières années pour combler ces lacunes et permettre un changement des politiques de santé publique vers le dépistage systématique de la sérologie pendant la grossesse. Autrement dit, le dépistage de la sérologie CMV au premier trimestre de la grossesse selon l’algorithme de la Figure 1. Est-il admissible selon les critères de l’OMS pour un programme de dépistage?
1) La condition recherchée devrait être un problème de santé important pour l’individu et la communauté. L’infection congénitale par le CMV est l’infection congénitale la plus fréquente avec une prévalence de 0,3 à 0,4 % dans les pays à haut revenu. Dans la plupart des pays européens, environ 50 % de tous les cas de CMV congénitaux sont dus à une infection maternelle primaire (3). Les séquelles à long terme se produisent chez les fœtus infectés après une infection primaire maternelle au premier trimestre (6,7). Par conséquent, le dépistage maternel dans le premier trimestre devrait identifier la moitié des fœtus congénitalement infectés et la moitié de ceux avec des séquelles. De plus les femmes jeunes ayant accouché moins de 3 ans avant une nouvelle grossesse et dont le nourrisson est en garde partagée ou en crèche présentent un risque de 7% de faire une infection au premier trimestre de la nouvelle grossesse.
2) Il devrait y avoir un traitement accepté ou une intervention utile pour les patients atteints de la maladie. Un taux de réduction de 71 % de l’infection fœtale a été rapporté dans un essai randomisé comparant le placebo au traitement maternel avec le valaciclovir chez les femmes atteintes d’une infection primaire au cours de leur premier trimestre de grossesse (12). Nous attendons la publication complète de cette étude pour estimer la solidité de ses résultats. Par ailleurs, l’échographie de routine dépiste moins de 25% des infections fœtales même sévère, l’expertise échographique des fœtus connus comme infectés est très pertinente et permet de donner le choix légitimes aux femmes enceintes de poursuivre ou d’interrompre une grossesse de mauvais pronostic. Rappelons ici que les possibilités thérapeutiques ne font pas partie des éléments justifiant du dépistage de la trisomie 21 fœtale (13).
3) Des parcours de soins pour le diagnostic et le traitement devraient être disponibles. La sérologie CMV est disponible dans la plupart des laboratoires des pays à forte ressources. Le test diagnostique de confirmation est la réalisation d’une amplification du génome viral par PCR dans le liquide amniotique qui peut être prélevé par amniocentèse à partir de 17 semaines de gestation et 8 semaines après la date présumée de l’infection primaire maternelle (13). Les PCR dans le liquide amniotique ont 100% de spécificité et 85 à 95% de sensibilité. Les faux résultats négatifs s’expliquent par un passage transplancentaire tardif du virus (13). Cependant, les nouveau-nés nés infectés après un diagnostic prénatal négatif, ont un excellent pronostic sans séquelles à long terme, probablement parce qu’ils sont infectés après le premier trimestre (13). Le pronostic d’un fœtus infecté repose sur l’imagerie prénatale (US et IRM) avec une valeur prédictive négative de l’imagerie fœtale (US et IRM combinée) comprise entre 95 et 99 % (13)).
L’échographie prénatale, l’amniocentèse et le test de PCR CMV sont largement disponibles sur tout le territoire national il existe deux centres nationaux de référence CMV à Limoges et à Necker à Paris. Toutefois, si le dépistage de la sérologie du CMV devait être mis en œuvre, des programmes de formation seraient nécessaires pour les acteurs de santé impliqués, y compris les biologistes formés à l’interprétation de la sérologie CMV et les échographistes réalisant les examens prénatals.
4) Il devrait y avoir un stade symptomatique latent ou précoce. Entre l’infection primaire maternelle et l’infection fœtale, il existe une fenêtre de temps propice à la prophylaxie, puisue le passage transplacentaire prend quelques semaines.
5) Il devrait y avoir un test ou un examen adapté et acceptable. Le dépistage de la sérologie CMV maternelle repose sur des tests IgG et IgM suivis de tests d’avidité d’IgG dans les cas avec IgM positif. La sensibilité et la spécificité de cet algorithme dépendent essentiellement de la performance des kits IgM utilisés et du moment du dépistage de la sérologie. La performance de la sérologie CMV pendant la grossesse a été estimée dans différentes études. Quatre études utilisant le même algorithme (IgG et IgM, avidité si positive IgM) mais différents kitsCMV IgG, ont rapporté une prévalence moyenne d’ IgM positives de 3,99% chez plus de 15 000 femmes enceintes dépistées (14). Chez les femmes avec IgM positives, une avidité forte des IgG exclut une infection primaire récente dans 60% à 76% des cas ; et une avidité faible ou intermédiaire des IgG identifie une infection primaire au premier trimestre ou dans la période périconceptionnelle dans 32 % des cas (14). La sensibilité moyenne du diagnostic d’une infection primaire dans le premier trimestre de la grossesse était de 93,5%.
Pour améliorer la sensibilité de la prophylaxie de la transmission fœtale, la sérologie devrait être proposée dès que la grossesse est connue, et répétée en fin de premier trimestre à 12-14 SA si elle était négative.
6) Le test utilisé devrait être acceptable pour la population. Un dépistage sérologique n’est pas invasif et généralement bien accepté. Dans une étude de dépistage réalisée en France seules 3 % des femmes ont refusé d’être dépistées.
7) L’histoire naturelle de la maladie devrait être bien comprise, dès son stade préclinique. L’histoire naturelle de l’infection primaire à CMV au premier trimestre de la grossesse est parfaitement comprise.
8) Il devrait y avoir un parcours de soins préétabli qui soit cohérent.
Toutes les femmes atteintes d’une infection primaire au cours du premier trimestre doivent aujourd’hui être traitées par valaciclovir, qui peut être arrêté si le résultat de l’amniocentèse est négatif, et qui peut être poursuivi jusqu’à la naissance si ce résultat est positif. Ce dernier aspect est soutenu par la probabilité d’un effet bénéfique de ce traitement, qui diminue la réplication virale, sur la présence de symptômes à la naissance même si un essai plus convaincant reste à réaliser.
9)Le coût devrait être économiquement équilibré par rapport aux dépenses éventuelles en soins médicaux dans leur ensemble. Deux études ont estimé la rentabilité du dépistage sérologique pendant la grossesse. Dans une étude, les auteurs ont modélisé une stratégie de dépistage unique du sérum et ont constaté que le dépistage universel de l’infection maternelle primaire était rentable si la prévention (par immunoglobuline ou par antiviral) permettait d’obtenir une réduction de plus de 47 % des maladies cliniques (15). Dans l’autre étude, les auteurs ont estimé que le dépistage universel serait rentable si la prévention de la transmission verticale était efficace à 30 % (16).
L’équilibre économique du dépistage sérologique pendant la grossesse devrait être modélisé dans chaque pays car il dépend de l’épidémiologie du CMV et du coût de l’intervention médicale.
Conclusion
Le traitement par valaciclovir a montré une réduction substantielle du taux de transmission de CMV au foetus chez les femmes avec une infection primaire au premier trimestre de grossesse et ceci constitue une avancée majeure (12). Cela devrait être pris en considération dans un ensemble de progrès réalisés dans 1) la compréhension de l’épidémiologie de l’infection primaire pendant la grossesse, et du risque de séquelles limité aux infections primaires du premier trimestre (5-7). Ce qui veut dire que les grossesses séronégatives après ce terme ne sont plus exposées à un risque de séquelles et que les femmes immunisées doivent faire l’objet d’un examen échographique particulièrement attentif au 2ème et au 3ème trimestre de la grossesse. 2) la performance des kits sérologiques pour diagnostiquer l’infection primaire 3) et l’interprétation des images prénatales échographiques et IRM chez les fœtus infectés.
Tout ceci devrait mener à recommander le dépistage sérologique du CMV dans le premier trimestre de la grossesse afin de transformer des risques en opportunités pour toutes les femmes enceintes.
Bibliographie
1. Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol. 2007 Aug;17(4):253–76.
2. Dollard SC, Grosse SD, Ross DS. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection. Rev Med Virol. 2007 Oct;17(5):355–63.
3. Leruez-Ville M, Magny J-F, Couderc S, Pichon C, Parodi M, Bussières L, et al. Risk Factors for Congenital Cytomegalovirus Infection Following Primary and Nonprimary Maternal Infection: A Prospective Neonatal Screening Study Using Polymerase Chain Reaction in Saliva. Clin Infect Dis Off Publ Infect Dis Soc Am. 2017 Aug 1;65(3):398–404.
4. Puhakka L, Renko M, Helminen M, Peltola V, Heiskanen-Kosma T, Lappalainen M, et al. Primary versus non-primary maternal cytomegalovirus infection as a cause of symptomatic congenital infection - register-based study from Finland. Infect Dis Lond Engl. 2017 Jun;49(6):445–53.
5. Picone O, Vauloup-Fellous C, Cordier AG, Guitton S, Senat MV, Fuchs F, et al. A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome. Prenat Diagn. 2013 Aug;33(8):751–8.
6. Faure-Bardon V, Magny J-F, Parodi M, Couderc S, Garcia P, Maillotte A-M, et al. Sequelae of Congenital Cytomegalovirus Following Maternal Primary Infections Are Limited to Those Acquired in the First Trimester of Pregnancy. Clin Infect Dis Off Publ Infect Dis Soc Am. 2019 Oct 15;69(9):1526–32.
7. Foulon I, De Brucker Y, Buyl R, Lichtert E, Verbruggen K, Piérard D, et al. Hearing Loss With Congenital Cytomegalovirus Infection. Pediatrics. 2019 Aug;144(2).
8. Pass RF, Fowler KB, Boppana SB, Britt WJ, Stagno S. Congenital cytomegalovirus infection following first trimester maternal infection: symptoms at birth and outcome. J Clin Virol Off Publ Pan Am Soc Clin Virol. 2006 Feb;35(2):216–20.
9. Society for Maternal-Fetal Medicine (SMFM), Hughes BL, Gyamfi-Bannerman C. Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol. 2016 Jun;214(6):B5–11.
10. Rawlinson WD, Boppana SB, Fowler KB, Kimberlin DW, Lazzarotto T, Alain S, et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy. Lancet Infect Dis. 2017 Jun;17(6):e177–88.
11. https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=702
12. Shahar-Nissan K, Pardo J, Peled O, Krame I, Bilavsky E, Wiznitzee A, et al. Valaciclovir to prevent vertical transmission of cytomegalovirus after maternalk primary infection during pregnancy. In ID Week Washington; 2019.
13. Leruez-Ville M, Foulon I, Pass R, Ville Y. Cytomegalovirus infection during pregnancy: State of the science Am J Obstet Gynecol 2020 PMID: 32105678
14. Leruez-Ville M, Sellier Y, Salomon LJ, Stirnemann JJ, Jacquemard F, Ville Y. Prediction of fetal infection in cases with cytomegalovirus immunoglobulin M in the first trimester of pregnancy: a retrospective cohort. Clin Infect Dis Off Publ Infect Dis Soc Am. 2013 May;56(10):1428–35.
15. Cahill AG, Odibo AO, Stamilio DM, Macones GA. Screening and treating for primary cytomegalovirus infection in pregnancy: where do we stand? A decision-analytic and economic analysis. Am J Obstet Gynecol. 2009 Nov;201(5):466.e1-7.
16. Albright CM, Werner EF, Hughes BL. Cytomegalovirus Screening in Pregnancy: A Cost-Effectiveness and Threshold Analysis. Am J Perinatol. 2019 Jun;36(7):678–87.



