Le gène MTHFR permet la transformation du 5,10-methylène-THF en 5-méthyl-THF. Cette réaction permet à son tour la transformation de l'homocystéine en methionine (figure 1). Une mutation du gène MTHFR bloque la synthèse de 5-méthyl-THF. Par conséquent, le reste du cycle (one-carbon cycle) est bloqué et en particulier l’homocystéine ne peut pas être métabolisée.
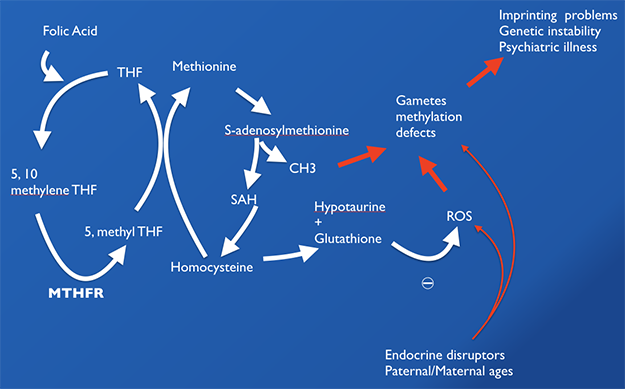
Figure 1
Le blocage du cycle entraine en aval une accumulation de dérivés oxygénés à l’origine de troubles oxydatifs, de problèmes de méthylation gamétique et d’empreinte.
De nombreuses mutations peuvent affecter le one-carbon-cycle. Les deux mutations les plus fréquemment décrites dans la littérature scientifique sont les mutations qui touchent les polymorphisme c.677 C>T et c.1298 A>C du gène de MTHFR. Ces mutations peuvent entrainer une capacité de synthétiser le 5MTHF jusqu’à 75% plus faible (van der Put, 1998).
Nous avons étudié la distribution de la mutation du gène MTHFR dans une population de plus de 2500 patients infertiles. 84% des patients sont porteurs d'au moins une des deux mutations du gène (tableau 1). Cette proportion est statistiquement plus importante que la proportion de patients mutés dans la population générale (Zappacosta, 2014). Par ailleurs, notons que dans notre population, aucun patient n'est porteur des deux mutations à l’état homozygote, ce qui pose la question du caractère viable de ce statut mutationnel.
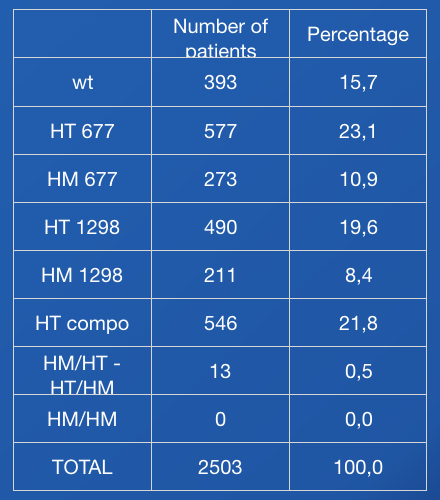
Tableau 1
Afin de mesurer l'impact de la mutation du gène MTHFR sur la valeur d’homocystéine, nous avons comparé les valeurs d’homocystéine en fonction des différents statuts mutationnels dans une cohorte de plus de 1400 patients infertiles (tableau 2). Il existe une corrélation statistique entre MTHFR et les valeurs d’homocystéine (p=0,002, test du chi2).
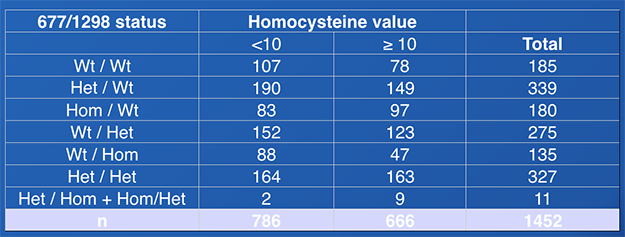
Tableau 2
L’hyperhomocystéinémie, conséquence notamment des mutations du gène MTHFR, a un impact nocif sur plusieurs organes. Les conséquences de l’hyperhomocystéinémie ont été décrites par de nombreux auteurs de différentes spécialités médicales.
Dans le domaine cardiovasculaire, plusieurs auteurs rapportent une corrélation entre hyperhomocystéinémie et accident coronarien aigu (Danesh, 1998; Ueland, 2000; Klerk, 2002; Chang, 2019). Une augmentation de 1µmol/L est associée avec une augmentation de 5% du risque d’accident coronarien (Klerk, 2002). Chez les patients mutés pour MTHFR, une diminution de la valeur d’homocystéine de 25% entraine une diminution de 19% du risque ischémique, quelque soit la valeur d’homocystéine de départ, après ajustement pour le tabac, la pression artérielle et le taux de cholestérol (Clarke, 2002). La majorité des auteurs n’évoquent pas de valeur basale "normale" pour l’homocystéine, et le cut-off retenu pour définir l’hyperhomocystéinémie n’est pas consensuel. Dans les essais concernant les accidents ischémiques, différentes valeurs sont retenues dans la littérature : dans les AVC, 15.45µmol/L pour Evers (1997); dans les accidents coronariens, respectivement 14.0µmol/L, 14.5µmol/L, 15.67µmol/L et 18.2µmol/L pour Hoogeveen (1998), Moustapha (1998), Blacher (1997) et Mendis (2002).
D’un point de vue oncologique, l’hyperhomocystéinémie et le statut mutationnel vis-à-vis du gène MTHFR sont décrits dans de nombreux cancers. L’hypothèse physiopathologique est que les anomalies du cycle des folates altèrent la réparation de l’ADN entrainant des aberrations chromosomiques à l’origine de la genèse des tumeurs (Hasan, 2019). On retrouve une association entre cancer colo-rectal, hyperhomocystéinémie (> 12µmol/L) et mutation du gène MTHFR (Shiao, 2018). Les valeurs d’homocystéine sont significativement plus élevées chez les patients atteints de cancer du poumon comparés au groupe contrôle : respectivement 15.3 et 9.8µmol/L (Tastekin, 2015). Les anomalies du cycle des folates entrainent une hypométhylation du génome à l’origine de plusieurs cancers : prostate métastatique, carcinome hépatocellulaire (Ehrlich, 2002).
L’hyperhomocystéinémie est également décrites dans d’autres pathologies : neurotoxiques à type de démence (Smith, 2016), psychiatriques : dépression (Brumette, 2017), ophtalmologiques : rétinoblastome (Bisht, 2018), osseuse : ostéoporose (Refsum, 2006), etc.
Face aux effets négatifs de l’hyperhomocystéinémie, diminuer la valeur de l’homocystéine pourrait avoir un effet préventif positif sur l’organisme.
La supplémentation en acide folique est considérée depuis de nombreuses années comme un dogme, étant donné que l'apport d’acide folique pendant la période de périconception diminue le risque de malformations du tube neural chez les nouveaux-nés (Hibbard, 1965). Or, l’acide folique est un composé synthétique qui doit subir une transformation avant de pouvoir entrer dans le cycle des folates (figure 1). Le cycle des folates est une composante indispensable de tous les processus de méthylation et il est lié au one carbon cycle qui recycle l'homocystéine en méthionine. Des doses élevées d’acide folique (5 mg / jour) sont généralement recommandées avant la conception car la fermeture du tube neural a lieu à partir du 28ème jour après la fécondation. Selon les recommandations traditionnelles, la supplémentation en acide folique pourrait corriger la déficience en folate nécessaire pour la synthèse nucléotidique et pour la synthèse en methionine. Or, un mauvais métabolisme de l’acide folique peut entraîner son accumulation à des concentrations élevées, entrainant un syndrome d’acide folique non métabolisé : UMFA - Unmetabolized Folic Acid Syndrom (Plumptre, 2015). Lorsque le foie est saturé, l’acide folique se retrouve dans la circulation entrainant un UMFA (www.sciencedaily.com/releases/2007/11/071102125139.htm).
Le syndrome UMFA est fortement soupçonné d'être impliqué dans la poussée de certaines tumeurs : colorectales et prostatiques (Crider, 2011). L’acide folique est métabolisé dans le foie. L’UMFA pourrait être problématique non seulement chez les couples en AMP mais également chez les patients stentés ou traités pour arthrose, psoriasis, leucémie et cancers solides car il réduirait la réponse aux drogues anti-folates (Smith, 2008). L’UMFA pourrait également réduire la réponse immunitaire par diminution des cellules NK chez les souris femelles âgées (Sawaengsri, 2013) et chez les femmes ménopausées (Troen, 2006).
Plusieurs essais cliniques ont montré que le 5-MTHF est plus efficace dans ses fonctions in vivo par rapport à l'acide folique. Un essai de 167 volontaires sains montre qu'une faible dose (113 microgrammes) de 5-MTHF est au moins aussi efficace que l'acide folique (100 microgrammes) pour générer du folate plasmatique, et est plus efficace pour réduire l’homocystéinémie (Venn, 2003). Une étude similaire menée chez 144 participantes ne retrrouve pas de différence entre le 5-MTHF et l'acide folique dans la réduction de la concentration de l’homocystéinémie, ce qui indique que le 5-MTHF est une alternative adéquate à l'acide folique (Lamers, 2004).
Notre équipe a inclus 125 couples infertiles testés pour le polymorphisme 677 du gène MTHFR et chez qui l’homocystéine a été dosée. Nous retrouvons des valeurs d’homocystéine significativement plus importante chez les patients homozygotes (18,4µmol/L) que chez les patients hétérozygotes (12,2µmol/L) et que chez les patients sauvages (7,9µmol/L). Après traitement des patients mutés avec 5-MTHF pendant une durée de 4 mois à la posologie de 400µg/j, les valeurs d’homocystéine ont significativement diminué à la fois chez les patients homozygotes (10,5µmol/L) et chez les patients hétérozygotes (9,8µmol/L) atteignant des valeurs quasi-équivalentes de celles retrouvés chez les patients sauvages sans traitement (7,9µmol/L) (Clément, 2019).
En résumé, les polymorphismes du gène MTHFR semblent jouer un rôle sur la fertilité via, notamment, l’hyperhomocystéinémie. Compte tenu du fait que l’hyperhomocystéinémie est également impliquée dans des pathologies intervenant sur des terrains plus agés (cardiovasculaires, oncologiques, etc), la découverte d’une hyperhomocystéinémie dans le cadre du diagnostic d’infertilité pourrait avoir un rôle préventif sur la survenue ultérieure de ces pathologies.
La prise en charge des effets des mutations du gène, en particulier l’hyperhomocystéinémie pourrait donc avoir un effet bénéfique non seulement sur la fertilité mais également en prévention d’autres pathologies (cardiovasculaires, oncologiques, etc). Dans l’optique de diminuer l’hyperhomocystéinémie tout en évitant le syndrome UMFA, l’utilisation de 5MTHF doit être préférée à l’acide folique.
Une consultation génétique peut également être recommandée afin d’évaluer l’impact des mutations du gène dans la famille.



