Patricia Fauque1,2
1 CHU Dijon Bourgogne, Laboratoire de Biologie de la Reproduction - CECOS, 14 rue Gaffarel, 21079 Dijon Cedex, France
2Unité INSERM 1231, Dijon, France
Abstract :
Des études épidémiologiques suggèrent que les singletons nés d’Assistance Médicale à la Procréation (AMP) présentent un risque élevé de complications néonatales, en particulier de pathologies congénitales comme celles liées à l’empreinte. Comme les processus d’AMP ont lieu à des moments où la reprogrammation épigénétique se produit, il est possible qu’elles puissent affecter l’empreinte génomique. Dans cet article, nous feront une synthèse des résultats de ces études épidémiologiques dont ceux d’une étude récente Française menée avec l’Agence Nationale de Biomédecine sur 3 501 496 singletons dont 84 406 conçus par AMP.
Introduction :
Les techniques d’Assistance Médicale à la Procréation (AMP), principalement l'insémination intra-utérine (IIU) et la fécondation in vitro (FIV), aident de nombreux couples à surmonter leur infertilité. Dans le monde, des millions d'enfants sont nés grâce à ces techniques, et représentent aujourd'hui plus de 4 % des naissances dans certains pays européens (1).
Même si la plupart de ces enfants sont considérés comme étant en bonne santé, on est de plus en plus conscient des conséquences potentielles de ces techniques sur un certain nombre de complications potentiellement liées à la dérégulation épigénétique (2).
Des études épidémiologiques suggèrent en effet que les enfants conçus par AMP ont un risque plus élevé de pathologies périnatales comme par exemple, un faible poids à la naissance après un transfert d'embryon frais et des anomalies liées au placenta (3, 4). En outre, il a également été retrouvé une augmentation de la prévalence de pathologies congénitales (Fauque et al 2020 HR), dont certaines rares liées à des modifications d’une famille de gènes particuliers, les gènes soumis à empreinte (GSEs) parentale impliqués dans le développement embryonnaire, fœtal et placentaire (fréquence de ces pathologies estimée dans la population générale à 1 cas sur 10 000 à 100 000 naissances, Tableau 1).
On retrouve en particulier au sein de ces pathologies, les syndromes de Beckwith-Wiedemann (BWS), Russell-Silver (SRS), Angelman (AS) et Prader-Willi (PWS) (5).
Nous allons après quelques explications sur le rationnel du risque épigénétique qui peut se rencontrer chez les enfants conçus par AMP, nous évoquerons les données épidémiologiques actuellement disponibles sur ce sujet. Enfin nous aborderons les facteurs potentiels en cause.
Rationnel : la reprogrammation épigénétique chez l’Homme
La période périconceptionnelle (gamétogenèse, fécondation et développement embryonnaire préimplantatoire) est physiologiquement soumise à une reprogrammation épigénétique intense ; ceci renforce en effet l’hypothèse de l’existence d’un risque de dérégulation épigénétique en contexte d’AMP nécessitant la manipulation in vitro de gamètes et des embryons.
Cette reprogrammation épigénétique intense de traduit notamment par des changements drastiques des profils de méthylation de l’ADN (Figure 1) (6). Ces remaniements sont essentiels pour la régulation de l’expression de gènes développementaux permettant la différentiation de lignages, mais aussi pour l’empreinte parentale. L’empreinte parentale reflète la non-équivalence des deux génomes parentaux, qui résulte d’un marquage épigénétique différentiel des génomes du spermatozoïde et de l’ovocyte, en particulier via la méthylation de l’ADN aux niveaux de régions spécifiques, les régions de contrôle de l’empreinte (ICRs, Imprinting Control Regions). Ce marquage épigénétique des ICRs doit résister à la déméthylation globale du génome après la fécondation (Figure 1). Ces ICRs vont participer à la régulation de GSEs au sein du même locus. Chacun de ces GSEs présente des régions (Differentially Methylated Regions) allèle-spécifique qui va se traduire par une expression mono-allélique et qui bien que représentent un petit nombre de régions génomiques vont jouer un rôle majeur dans le développement et la croissance embryonnaire. Des modifications (perte de méthylation appelée aussi épimutation ou bien modifications cytogénétique avec des mutations/délétions etc) au niveau de ces régions sont à l’origine des syndromes de pathologies liées à l’empreinte.
Or, comme on peut le voir sur la Figure 1, les techniques d’AMP interviennent durant ces grands remaniements épigénétiques, en particulier lors des modifications des niveaux de méthylation de l’ADN.
Données épidémiologiques chez l’Homme
Des études épidémiologiques menées jusqu’ici ont montré que les enfants nés après AMP pourraient présenter un risque accru de troubles rares de l'empreinte. En effet, plusieurs publications ont retrouvé en effet une augmentation du pourcentage de patients nés après AMP dans la population de patients atteints du syndrome de BWS ou bien une augmentation de cas de BWS chez les enfants conçus par AMP (7-9). Ce risque est variable selon les études (Tableau 1). Au total, le risque relatif estimé à partir de huit publications relatives au BWS serait de 5,2 (IC95% 1,6-7,4) (10). Cependant, pour la plupart des études de population explorant le BWS, le risque a été établi à partir de participation volontaire (8, 11-13) et peu d'entre elles se sont basées sur des registres nationaux complets (9, 14, 15) (Tableau 1). De plus, parmi les registres nationaux, deux étaient basés sur des registres de patients (Gicquel et al. en France (9); Kallen et al. en Suède (14)), et un était basé sur les registres Danois avec un nombre relativement faible d'enfants conçus par AMP (6 052 enfants nés après une FIV/ICSI) (15). Le groupe « santé des mères et des enfants issus d’AMP » de l’Agence de Biomédecine a récemment retrouvé dans sa grande étude de cohorte étudiant 3 501 496 singletons dont 84 406 conçus par AMP, un sur-risque global de pathologies en lien avec les GSEs chez les enfants conçus par FIV et plus particulièrement après un transfert d’embryon frais (16). Ces données questionnent sur la vulnérabilité épigénétique induite par l’AMP mais excepté cette dernière étude de cohorte nationale, aucune étude jusqu’alors n’avait pris en considération dans les analyses l’origine de l’infertilité des couples. Il est intéressant de souligner que cette étude Française a pu démontrer que l’infertilité féminine expliquerait 20% de l’excès de risque de malformations majeures congénitales retrouvé chez les enfants conçus par AMP et que l’endométriose serait associée à une augmentation du risque de pathologies en lien avec les GSEs chez leurs enfants indépendamment de leur mode de conception (1,38 aOR [95%CI 1,06–1,80]) (17, 16). Toutefois, la prévalence des pathologies en lien avec les GSEs reste faible, elle est de 0,26 % dans le groupe des patients atteints d'endométriose, contre 0,14 % dans le groupe sans endométriose (16).
Facteurs impliqués
Les nombreuses manipulations et processus en lien avec l’AMP, à savoir la stimulation hormonale, la manipulation, la culture et la cryoconservation des embryons, interviennent dans le même temps que la reprogrammation épigénétique et l'empreinte génomique (c'est-à-dire pendant la gamétogenèse féminine et le développement préimplantatoire de l'embryon), ce qui fait craindre que ces techniques d’AMP, elles-mêmes ou cumulées, puissent avoir un effet négatif sur l'épigénétique et l'établissement/le maintien de l’empreinte génomique. La période du développement embryonnaire précoce est en effet cruciale du fait de la mise en place d’évènements majeurs tels que l’activation du génome embryonnaire ou les 1ères ségrégations de lignées cellulaires (cellules de la masse cellulaire interne et du trophectoderme), elles-mêmes liées aux changements épigénétiques. L’origine de ce risque épigénétique potentiel est un sujet complexe. En effet, d’autres facteurs pourraient également être en cause à savoir la réceptivité endométriale modifiée par les traitements hormonaux mais aussi l’exposition et l’environnement intra-utérin et enfin l’hygiène de vie. Par ailleurs, comme nous l’avons vu, l’infertilité parentale peut également jouer un rôle dans l'incidence accrue de ces pathologies (16).
Conclusion
Identifier un sur-risque de pathologies rares liées à l’empreinte nécessite de larges cohortes chez l’Homme. Pour montrer une augmentation de risque de 5 après AMP (l’incidence de BWS atteindrait 1 cas /2.700 naissances après AMP versus 1 cas/14.000 naissances obtenues naturellement), il faudrait des groupes de > 45 000 naissances pour démontrer une différence statistiquement significative (avec un risque α de 5% et β de 20%) (10).
Quoiqu’il en soit un autre élément alerte sur l’existence de ce risque à savoir que presque tous les cas de pathologies liées à l’empreinte retrouvés chez les enfants conçus par AMP sont rattachés à la perte de marques épigénétiques dans les régions qui contrôle de l'empreinte (épimutations) ce qui n’est pas le cas des enfants conçus naturellement qui présentent aussi des anomalies cytogénétiques au diagnostic moléculaire (18, 19).
Par ailleurs, à côté de ce sur-risque de pathologies rares, les contraintes extrinsèques in vitro pourraient, pour certaines, modifier les changements épigénétiques, ce qui pourrait être sans conséquence immédiate mais avoir des conséquences potentielles en pré et post-natal voire à plus long terme, nécessitant encore toute notre attention et le besoin d’avoir un suivi de la santé de ces enfants conçus par AMP jusqu’à l’âge adulte.
Légende
Figure 1: Changements dans la méthylation de l'ADN au cours de la gamétogenèse et de l'embryogenèse.
La première vague de déméthylation globale du génome a lieu au niveau des cellules germinales primordiales (Primordial Germ Cells, PGCs) puis une nouvelle empreinte est réapposée pendant la gamétogenèse sexe-spécifique. Juste après la fécondation, survient une nouvelle vague de déméthylation du génome embryonnaire à laquelle échappent les ICRs (Imprinting Control Regions). Au stade blastocyste, une méthylation de novo intervient. Les tissus extra-embryonnaires présentent une reméthylation moins marquée que les autres tissus.
Références
1. De Geyter C, Calhaz-Jorge C, Kupka MS, Wyns C, Mocanu E, Motrenko T et al. ART in Europe, 2014: results generated from European registries by ESHRE: The European IVF-monitoring Consortium (EIM) for the European Society of Human Reproduction and Embryology (ESHRE). Hum Reprod 2018;33:1586-601.
2. Argyraki M, Damdimopoulou P, Chatzimeletiou K, Grimbizis GF, Tarlatzis BC, Syrrou M et al. In-utero stress and mode of conception: impact on regulation of imprinted genes, fetal development and future health. Hum Reprod Update 2019;25:777-801.
3. Choux C, Carmignac V, Bruno C, Sagot P, Vaiman D, Fauque P. The placenta: phenotypic and epigenetic modifications induced by Assisted Reproductive Technologies throughout pregnancy. Clin Epigenetics 2015;7:87.
4. Qin J, Sheng X, Wang H, Liang D, Tan H, Xia J. Assisted reproductive technology and risk of congenital malformations: a meta-analysis based on cohort studies. Arch Gynecol Obstet 2015;292:777-98.
5. Cortessis VK, Azadian M, Buxbaum J, Sanogo F, Song AY, Sriprasert I et al. Comprehensive meta-analysis reveals association between multiple imprinting disorders and conception by assisted reproductive technology. J Assist Reprod Genet 2018;35:943-52.
6. Barberet J, Barry F, Choux C, Guilleman M, Karoui S, Simonot R et al. What impact does oocyte vitrification have on epigenetics and gene expression? Clin Epigenetics 2020;12:121.
7. Halliday J, Oke K, Breheny S, Algar E, D JA. Beckwith-Wiedemann syndrome and IVF: a case-control study. Am J Hum Genet 2004;75:526-8.
8. DeBaun MR, Niemitz EL, Feinberg AP. Association of in vitro fertilization with Beckwith-Wiedemann syndrome and epigenetic alterations of LIT1 and H19. Am J Hum Genet 2003;72:156-60.
9. Gicquel C, Gaston V, Mandelbaum J, Siffroi JP, Flahault A, Le Bouc Y. In vitro fertilization may increase the risk of Beckwith-Wiedemann syndrome related to the abnormal imprinting of the KCN1OT gene. Am J Hum Genet 2003;72:1338-41.
10. Vermeiden JP, Bernardus RE. Are imprinting disorders more prevalent after human in vitro fertilization or intracytoplasmic sperm injection? Fertil Steril 2013;99:642-51.
11. Bowdin S, Allen C, Kirby G, Brueton L, Afnan M, Barratt C et al. A survey of assisted reproductive technology births and imprinting disorders. Hum Reprod 2007;22:3237-40.
12. Maher ER, Brueton LA, Bowdin SC, Luharia A, Cooper W, Cole TR et al. Beckwith-Wiedemann syndrome and assisted reproduction technology (ART). J Med Genet 2003;40:62-4.
13. Sutcliffe AG, Peters CJ, Bowdin S, Temple K, Reardon W, Wilson L et al. Assisted reproductive therapies and imprinting disorders--a preliminary British survey. Hum Reprod 2006;21:1009-11.
14. Kallen B, Finnstrom O, Nygren KG, Otterblad Olausson P, Wennerholm UB. In vitro fertilisation in Sweden: obstetric characteristics, maternal morbidity and mortality. BJOG 2005;112:1529-35.
15. Lidegaard O, Pinborg A, Andersen AN. Imprinting diseases and IVF: Danish National IVF cohort study. Hum Reprod 2005;20:950-4.
16. Fauque P, De Mouzon, J., Devaux, A., Epelboin, S., Gervoise-Boyer, M.J., Levy, R., Valentin, M., Viot, G., Bergère, M., De Vienne, C., Jonveaux, P., Pessione, F. Reproductive technologies, female infertility and the risk of imprinting-related disorders. Clin Epigenetics 2020;in press.
17. Fauque P, De Mouzon J, Devaux A, Epelboin S, Gervoise-Boyer MJ, Levy R et al. Do in vitro fertilization, intrauterine insemination or female infertility impact the risk of congenital anomalies in singletons? A longitudinal national French study. Hum Reprod 2021;36:808-16.
18. Manipalviratn S, DeCherney A, Segars J. Imprinting disorders and assisted reproductive technology. Fertil Steril 2009;91:305-15.
19. Tenorio J, Romanelli V, Martin-Trujillo A, Fernandez GM, Segovia M, Perandones C et al. Clinical and molecular analyses of Beckwith-Wiedemann syndrome: Comparison between spontaneous conception and assisted reproduction techniques. Am J Med Genet A 2016;170:2740-9.
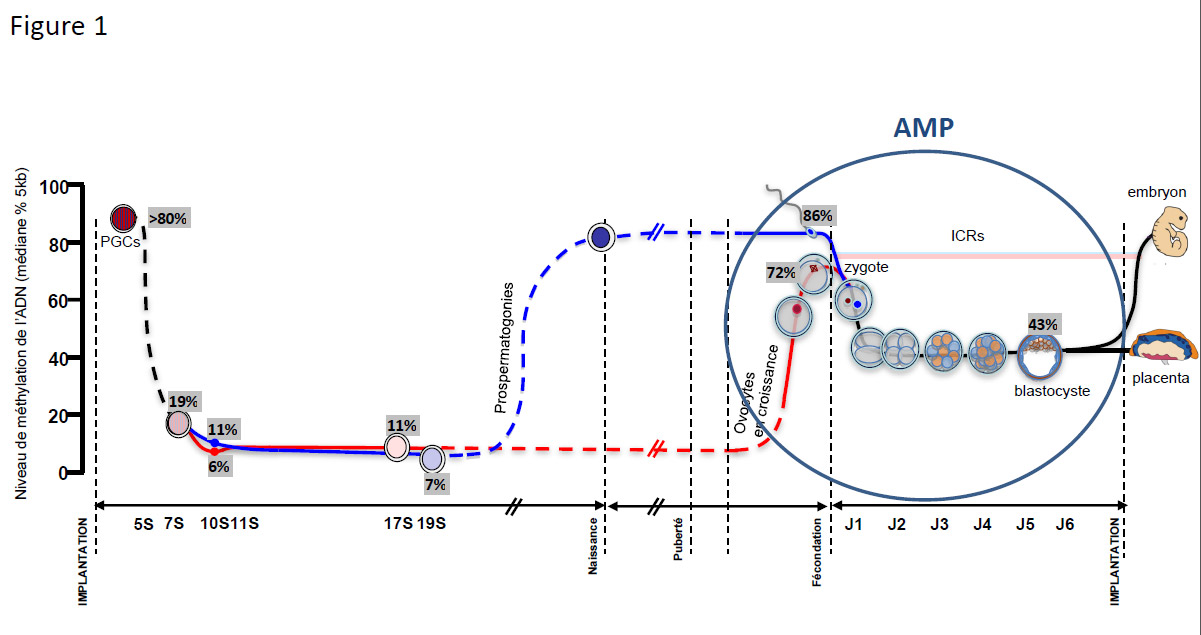
Tableau 1: Principaux syndromes liés à l’empreinte et AMP
| Syndromes |
Phénotypes |
Prévalence dans la population générale -ORPHANET |
|
Etudes de cohorte |
|||
|
Références |
Pourcentage d’AMP/ |
Pays |
Database |
||||
|
Syndrome de Beckwith-Wiedemann |
Croissance excessive, défauts de paroi abdominale antérieure, prédisposition aux tumeurs et au cancer, macroglossie, etc. |
1-5:10,000 |
Doornbos et al. 2007 Hiura et al. 2006 |
% d’AMP/BWS: 8.5%, RR=4.0 mais NS après correction avec l’infertilité |
Pays-Bas Japon |
Questionnaires Questionnaires |
|
|
Syndrome de Silver-Russell |
Asymétrie, retard de croissance, maladies de l'adulte, traits du visage, etc. |
1-9:1,000,000 |
Hiura et al. 2006
|
% d’AMP /SRS: 9.5%, RR=10 |
Japon |
Questionnaires |
|
|
Syndrome de Prader-Willi |
Hypotonie, infertilité, troubles mentaux, etc. |
1-9:100,000 |
Doornbos et al. 2007 Hiura et al. 2006 |
% d’AMP /PWS: 4.7% RR=2.2 mais NS après correction avec l’infertilité |
Pays-Bas Japon |
Registre national de PWS Registre national de PWS |
|
|
Syndrome d’Angelman |
Comportement anormal avec rires excessifs, déficience intellectuelle, ataxie, etc. |
1-9:100,000 |
Doornbos et al. 2007 Hiura et al. 2006
|
% d’AMP /AS: 6.3% RR=3.0 b mais NS après correction avec l’infertilité |
Pays-Bas Japon |
Questionnaires Registre national d’AS |
|
NS: non significatif;
*RR avec corrections tenant compte des non-réponses



