Analyse d’article.
Transfer of blastocysts with deviant morphological and morphokinetic parameters at early stages of in-vitro development : a case series.
Reproductive BioMédecine Online In Press.
Astrid Stecher, Pierre Vanderzwalmen, Martin Zintz, Barbera Wirleitner, Maximilian Schuff, Dietmar Spitzer, Nicolas H. Zech.
En Assistance Médicale à la Procréation, le biologiste de la reproduction a un rôle important dans le choix de l’embryon à transférer pour avoir les meilleures chances d’implantation, et de grossesse évolutive ; ceci si possible en privilégiant le transfert d’un embryon unique (Single Embro Transfer) afin de limiter au maximum le risque de grossesse multiple.
Dans ce contexte, les biologistes ont essayé de mettre en place des critères morphologiques de choix à partir de l’ovocyte jusqu’au blastocyste.
Cet article des membres d’une équipe autrichienne (Centre de Fécondation In Vitro de Bregenz en Autriche) et d’une équipe belge (Centre Hospitalier Inter régional Edith Cavell à Bruxelles) reprend ces différents critères morphologiques que ce soit des critères « statiques » ou « cinétiques ».
Depuis les débuts de la fécondation in vitro, les biologistes se sont principalement basés sur des critères morphologiques statiques des ovocytes, des zygotes, des embryons (à J2 et à J3) ou des blastocystes, dans le choix des embryons à transférer ou à congeler.
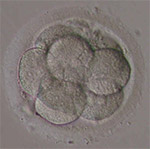
Embryon à J3
Concernant l’ovocyte, des critères dysmorphiques ont été retenus comme étant de mauvais pronostic pour une implantation embryonnaire : cytoplasme très granuleux, vacuolisation importante du cytoplasme, présence d’une quantité importante de réticulum endoplasmique (SER) autour du noyau, anomalie de la zone pellucide et du globule polaire (Figueira et al, 2010). Ces anomalies sont décrites comme délétères pour le développement embryonnaire (Rienzi et al, 2008, 2011). Ceci étant, tous les auteurs ne retrouvent pas de corrélation entre certaines de ces anomalies ovocytaires et le taux de fécondation ou la morphologie du zygote (Fancsovtis et al, 2012).
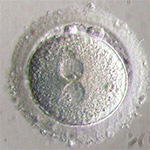
Zygote à 2PN
Les critères morphologiques du zygote sont également utilisés par certaines équipes, notamment la structure et la position des pronuclei de chaque noyau et pour cela des scores ont même été mis en place, afin d’utiliser ce critère comme choix du futur embryon à transférer (Scott et al, 2000). Ainsi plusieurs études ont montré une corrélation entre ces scores du zygote et un développement embryonnaire jusqu’au stade blastocyste (Rienzi et al, 2003) voir même avec le taux de grossesse (Wittemer et al, 2000).
D’autres critères concernant l’embryon ont été décrits par certains comme ayant un mauvais pronostic sur le développement embryonnaire : un clivage irrégulier (Scott et al, 2007), une multinucléation (Hardarson et al, 2001) sont décrits comme associés à une aneuploïdie de l’embryon, alors que d’autres équipes ne retrouvent pas cette association (Staessen et Van Steirteghem, 1998 ; Van Royen et al, 2003).
Concernant l’embryon J2-J3, les critères utilisés par les équipes sont le nombre de cellules, la régularité de celle ci et le pourcentage de fragments présents dans l’embryon (Alikani et al, 1999). Le TOP embryon étant défini comme présentant 4 cellules à J2 ou 6-8 cellules à J3, des cellules régulières et moins de 10% de fragments. Ceci étant cet article nous rappelle que ces critères sont très suggestifs, notamment le taux de fragmentation qui peuvent varier dans le temps (Lemmen et al, 2008).
.jpg)
Spermatozoïde
Une nouvelle technologie (« Time Laps ») nous permet aujourd’hui d’avoir une approche cinétique de la morphologie embryonnaire. Cette méthode basée sur une lecture de la morphologie à des temps très rapprochés (toutes les 10 à 20 minutes) remet en cause les critères morphologiques « statiques » utilisés jusqu’à maintenant, et montre le coté suggestifs de ceux ci, notamment en ce qui concerne la notion de fragmentation de l’embryon puisque celui ci a la capacité de les résorber. Ces nombreuses lectures permettent d’avoir un nombre très important de données (Kirkegaard et al, 2012) que plusieurs équipes ont essayé d’utiliser à travers des scores (Meseguer et al, 2011 ; Rubio et al, 2012). Certaines équipes allant même jusqu’à proposer des critères permettant de distinguer les embryons euploïdes des aneuploïdes (Campbell et al, 2013).
Les auteurs de cet article ont repris plusieurs cas de couples infertiles pour lesquels ont été réalisées des IMSI. Ils ont récupérés les données des analyses morphologiques statiques (analyses réalisées en double par deux opérateurs) et cinétiques (Time Laps). Les cultures embryonnaires pour ces tentatives allaient jusqu’au stade blastocyste et les blastocystes étaient analysés selon la classification de Gardner (Gardner et al, 2000). Pour neuf cas décrits dans l’article, où les critères de morphologie embryonnaire précoce statique et/ou cinétique étaient défavorables, ils ont obtenu des blastocystes (ayant des critères morphologiques variables selon la classification de Gardner) et des grossesses évolutives.
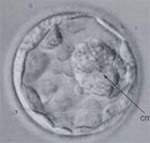
Blastrocyste
Ces résultats confirment le caractère subjectif des critères morphologiques statiques, mais également des critères cinétiques obtenus grâce à la technologie « Time Laps ».
Les auteurs posent la question de la pertinence des critères retenus comme favorables ou défavorables dans la cinétique de développement embryonnaire.
Il est certain que ces embryons ont un potentiel d’implantation plus faible, mais ils ne doivent pas être systématiquement écartés au stade précoce, dans la mesure où les chances de grossesses évolutives ne sont pas nulles. Les auteurs rappellent que le critère de développement de l’embryon jusqu’au stade blastocyste permet d’avoir un meilleur regard sur son développement (notamment parce qu’il y a passage du stade d’activation du génome embryonnaire), mais aussi que l’implantation embryonnaire est plus efficace à ce stade grâce à une meilleure synchronisation avec la muqueuse utérine (Papanikolaou, 2008).
Ainsi de nombreux auteurs donnent plus d’intérêts pronostic au fait d’obtenir un blastocyste qu’aux critères morphologiques de l’embryon précoce (Shaw-Jackson et al, 2013).
Commentaires.
Cet article permet une réflexion sur plusieurs points :
- une nouvelle technique d’observation des embryons comme le Time laps permet d’obtenir de nouveaux et nombreux critères de qualité de l’embryon, mais ceux ci restent subjectifs et doivent continuer à être évalués afin d’être affinés comme le font plusieurs équipes (Lammers J et al, 2014)
- dans le respect du décret n° 2012-360 du 14 mars 2012, une nouvelle technique (ou nouveau procédé) d’AMP doit faire la preuve de son efficacité avant d’être proposée en routine. Cette démarche sera également nécessaire pour un dépôt de dossier à la Haute Autorité de Santé pour une demande de mise à la nomenclature des actes de biologie médicale.
- la culture prolongée au stade blastocyste garde certaines indications parmi les choix techniques à notre disposition dans un centre d’AMP, et ceci, même en cas d’utilisation du Time Laps.
- la sélection des embryons à congeler au stade J2-J3 actuellement encore très subjective (y compris avec l’utilisation de marqueurs cinétiques de qualité du développement embryonnaire précoce), et la mise en culture prolongé d’embryons surnuméraires qui n’auraient pas été congelés à J2 ou J3, permet d’obtenir dans certains cas des blastocystes qui pourront être cryoconservés, avec de meilleurs résultats grâce à la vitrification et des chances de grossesse évolutives.
Ce dernier élément est renforcé par le fait que grâce à la technique de vitrification, des blastocystes de moins bonne qualité résistent mieux à la technique de cryoconservation (Wirleitner et al, 2013).
Références.
Figueira RD, De Almeida Ferreira Braga CP, et al (2010)
Metaphase II human oocyte morphology : contributing factors and effects on fertilization potential and embryo developmental ability in ICSI.
Fertil Steril, 94, 1115-1117
http://www.ncbi.nlm.nih.gov/pubmed/20045105
Rienzi L, Ubaldi F, Iacobelli M et al (2008).
Significance of metaphase II human oocyte morphology on ICSI outcome.
Fertil Steril, 90, 1692-1700
http://www.ncbi.nlm.nih.gov/pubmed/18249393
Fancsovits P, Tothne ZG, Murber A et al (2012)
Importance of cytoplasmic granularity of human oocytes in vitro fertilization treatments.
Acta. Biol. Hung, 63, 189-201.
http://www.ncbi.nlm.nih.gov/pubmed/22695519
Rienzi L, Vajta G, Ubaldi F (2011).
Predictive value of oocyte morphology in human IVF : a systematic review of the litterature.
Hum Reprod Update, 17, 34-35
http://www.ncbi.nlm.nih.gov/pubmed/20639518
Scott L, Alvero R, Leondires M et al (2000).
The morphology of human pronuclear embryo is positively related to blastocyst development and implantation
Hum Reprod, 15, 2394-2403
http://www.ncbi.nlm.nih.gov/pubmed/11056141
Rienzi L, Ubaldi F, Iacobelli M et al (2003)
Day 3 embryo transfer with combined evaluation at the pronuclear and cleavage stages compares favourably with day 5 blastocyst transfer.
Fertil Steril, 80, 67-74
http://www.ncbi.nlm.nih.gov/pubmed/12093851
Wittemer C, Bettahar-Lebugle K, Rongières C, Nisand I, Gerlinger P (2000).
Zygote evaluation : an efficient tool for embryo selection.
Hum Reprod, 15, 2591-2597.
http://www.ncbi.nlm.nih.gov/pubmed/11098032
Hardarson T, Hanson C, Sjogren A et al (2001)
Human embryos with unevenvly sized blastomeres have lower pregnancy and implantaiton rates : indication for aneuploidy and multinucleation.
Hum Reprod, 16, 316-318.
http://www.ncbi.nlm.nih.gov/pubmed/11157826
Staessen C, Van Steirteghem A (1998).
The genetic constitution of multinuclear blastomere and their derivative daughter blastomeres.
Hum Reprod, 13, 1625-1631
http://www.ncbi.nlm.nih.gov/pubmed/9688403
Van Royen E, Mangelschots K, Vercruyssen P et al (2003).
Multinucleation in cleveage stage embryos
Hum Reprod, 18, 1062-1069
http://www.ncbi.nlm.nih.gov/pubmed/12721185
Alikani M, Cohen J, Tomkin G et al (1999)
Human embryo fragmentation in vitro and its implication for pregnancy and implantation.
Fertil Steril, 71, 836-842
http://www.ncbi.nlm.nih.gov/pubmed/10231042
Lemmen JG, Agerholm IE, Ziebe S (2008)
Kinetic markers of human embryo quality using time-laps recording of IVF/ICSI fertilized oocytes.
Reprod Biomed Online, 17, 385-391
http://www.ncbi.nlm.nih.gov/pubmed/18765009
Kirkegaard K, Agerholm IE, Ingerslev HJ (2012)
Time-laps monitoring as a tool for clinical embryo assement.
Hum Reprod, 27, 1277-1285
http://www.ncbi.nlm.nih.gov/pubmed/22419744
Meseguer M, Herrero J, Tejera A et al (2011).
The use of morphokinetics as a predictor of embryo implantation.
Hum Reprod, 26, 2658-2671.
http://www.ncbi.nlm.nih.gov/pubmed/21828117
Campbell A, Fishel S, Bowman N et al (2013).
Modelling a risk classification of aneuploidy in human embryos using non-invasive morphokinetics.
Reprod Biomed Online.
http://www.ncbi.nlm.nih.gov/pubmed/23518033
Gardner DK, Lane M, Stevens L et al (2000)
Blastocyst score affects implantation and pregnancy outcome : towards a single blastocyst transfer.
Fertil Steril, 73, 1115-1158
http://www.ncbi.nlm.nih.gov/pubmed/10856474
Papanikolaou EG, Kolibianakis EM, Tournaye H et al (2008)
Live birth rates after transfer of equal number of blastocyst or cleavage-stage embryos in IVF. A systematic review and meta-analysis.
Hum Reprod, 23, 91-99
http://www.ncbi.nlm.nih.gov/pubmed/17965420
Shaw-Jackson C, Bertrand E, Becker B et al (2013).
Vitrification of blastocysts derived from fair to poor quality cleavage stage embryos ca produce high pregnancy rates warming.
J. Assist reprod Genet, In press.
http://www.ncbi.nlm.nih.gov/pubmed/23838796
Wirleitner B, Zech NH, Stecher A et al (2013).
Should we exclude reduced and low quality blastocysts from vitrification ?
17th World Congress In Vitro Fertilization
Lammers J, Splingart C, Barrière P, Fréour T (2014)
Morphokinetic parameters of ICSI tripronucleated embryos observed using time lapse.
Reprod Biomed Online, In Press.



