Patrice CLEMENT, Kay ELDER, Géraldine VIOT, Yves MENEZO
Introduction
L’Hyperhomocystéinémie (Hhcy) est maintenant reconnue comme étant un marqueur clinique et biologique important et sensible de la santé d’un individu. L’hyperhomocystéinémie indique un dérangement de deux cycles biochimiques/métaboliques, à l’origine de la vie : le cycle des folates et le cycle de la méthionine. Ces deux cycles sont indispensables pour un métabolisme cellulaire correct mais aussi pour la régulation de l’empreinte et de l’épigénèse. Le processus de méthylation, qui ajoute un groupement méthyl (-CH3) sur une grande variété de molécules cibles est un processus post -traductionnel ubiquitaire, qui régule la structure et la polarité finales des molécules impliquées. L’épigénèse joue un rôle crucial dans la différenciation cellulaire, ainsi elle a une influence capitale sur la fertilité entre autres, mais aussi sur la santé en général et a contrario sur la genèse de nombreuses pathologies [1].
En reproduction, le processus de méthylation est fortement impliqué dans la gamétogénèse, sachant que les génomes paternels et maternels ne sont pas équivalents mais complémentaires pour créer un individu viable. Ce sont les marquages « méthyl » positionnés (sur l’ADN) différemment quantitativement et qualitativement entre mâles et femelles qui activeront ou réprimeront certains gènes : processus appelé « empreinte ». Puis le développement embryonnaire nécessitera, selon un processus similaire, des modifications épigénétiques qui dirigeront l’expression et/ou la répression de certains autres gènes pour engager puis maintenir la différentiation cellulaire et l’identité cellulaire pendant toute la croissance. Le marquage de l’ADN par les groupements méthyl modifie également sa conformation et sa structure tridimensionnelle qui facilitera l’accès des facteurs de transcription impliqués dans l’expression génique.
Lors de la gamétogénèse, les informations épigénétiques héritées de la génération précédente sont d’abord totalement « effacées » dans les cellules germinales primordiales (PGC) par effacement complet des marquages méthyl, puis elles seront rajoutées à ces cellules en fonction du sexe de l’individu à savoir si elles sont destinées à former un ovocyte ou des spermatozoïdes. Ces PGC subiront une reprogrammation/re-méthylation totale. Cette reprogrammation se reproduira lors de la fin de l’embryogénèse pour l’embryon male, et au moment de l’acquisition de la puberté chez la jeune femme [2]. Le spermatozoïde mature possède un ADN très compacté du fait de son interaction avec les protamines qui seront remplacées par les histones ovocytaire lors de la fécondation. Ceci permettra, sous influence du glutathion, une décondensation du noyau et l’activation ovocytaire associée rapidement à la première phase de synthèse. Pendant ces premiers évènements biochimiques et cellulaires majeures, une méthylation de maintenance est active. Elle permettra de réguler la transcription et l’expression génique qui se produira ultérieurement J3 post fécondation chez l’humain. Par ailleurs, la méthylation de l’ADN au niveau des gènes et des promoteurs favorisera ou inhibera l’interaction de l’ADN avec, soit les facteurs de transcription, soit les microRNAs inhibiteurs de transcription ou de traduction des gènes. Ces mécanismes sont d’importance majeure pour le développement et la différenciation cellulaire.
La méthylation et sa régulation
Le processus de méthylation est dépendant exclusivement d’une molécule, la SAM, S-AdenosylMéthionine. Les molécules cibles sont méthylées par transfert du groupement méthyl de la SAM, avec libération concomitante de SAH, S-AdenosylHomocysteine qui est hydrolysée en Adénosine et Homocystéine (Hcy), par la SAH hydrolase ((SAHH, EC 3.3.1.1). Un ratio a l’équilibre s’établit à Hcy/SAH>3. L’homocystéine est un aminoacide connu pour induire des erreurs métaboliques et de détérioration du métabolisme en général. L’homocystéine doit rapidement être recyclée en Méthionine (Met), via une voie métabolique/prédominante/universelle, la Méthionine Synthase (MS), (Figure 1), qui a comme cofacteurs Le Zinc, le 5 Methyl THF (5 Methyltetrahydrofolate) et la vitamine B12. Une autre voie métabolique de l’homocystéine, la Bétaïne Méthyltransférase (BHMT) permet aussi cette régénération, mais elle est surtout présente dans le foie et dans le rein, mais pas dans la sphère génitale en général ni dans le jeune embryon en particulier.
L’hyperhomocystéinémie est aggravée en présence de polymorphismes (SNPs) du gène MTHFR (Méthylène TetraHydrofolate réductase), enzyme clé dans le cycle des folates (Voir Figure jointe). Deux polymorphismes C677T et A1298C, sont particulièrement pénalisants. De fait chez les patients porteurs de T677T à l’état homozygote, ou porteur de la double hétérozygotie A1298C et C677T, l’activité MTHFR peut être réduite jusqu’à 70%. De façon paradoxale, chez certains patients porteurs de ces variants MTHFR SNPs la montée d’homocysteine circulante n’est pas toujours observée. Chez nos patients hypofertiles testés [3], (2439 femmes et 2157 hommes), une prévalence de l’allèle 677T de 54.6% est observée : 11% pour les homozygotes T677T, 23.9% pour les hétérozygotes C677T et 19.7%pour les doubles hétérozygotes C677T/A1298C. Les couples porteurs de ces SNPs (surtout pour les deux formes les plus à risques d’hyperhomocystéinémie) peuvent éventuellement concevoir des enfants dont la santé pourra être affectée par cette élévation de l’homocystéine, antérieurement et/ou pendant la grossesse [4].
Hyperhomocystéinémie et inhibition des processus de méthylation
L’homocystéine est maintenant reconnue comme un inhibiteur direct et indirect de méthylation [5]. A l’élévation de la SAH est associée une hypo-méthylation globale et une chute de l’index de méthylation [6,7]. Quant à savoir qui de la SAH ou de l’homocystéine a un effet inhibiteur plus conséquent, il s’agit là du paradoxe de l’œuf et de la poule. Il y a toujours corrélation entre la teneur en SAH et en Homocystéine qui augmentent parallèlement ; Hcy n’est produit que par hydrolyse de la SAH, et, à l’équilibre le ratio Hcy/SAH est d’environ 3.1.
Ceci est lié au fait que Hcy est plus aisément transporté dans les cellules que le SAH. Par ailleurs Hcy, Méthionine et Cystéine partagent les mêmes transporteurs d’acides aminés [5,8]. Des expériences réalisées sur des embryons de souris, montrent, qu’à concentrations identiques, Hcy inhibe l’incorporation de Méthionine et la formation de SAM, l’agent universel de méthylation de 38 et de 36% respectivement au stade 1 Cellule et de 66% et de 78% au stade blastocyste. Le fait que Cystéine et Hcy partage le même transporteur affecte la production de Glutathion, l’antioxydant ubiquitaire, mais aussi les protéines utilisant le glutathion comme cofacteur (Glutaredoxines, thiol sulfide oxydoréductase…).
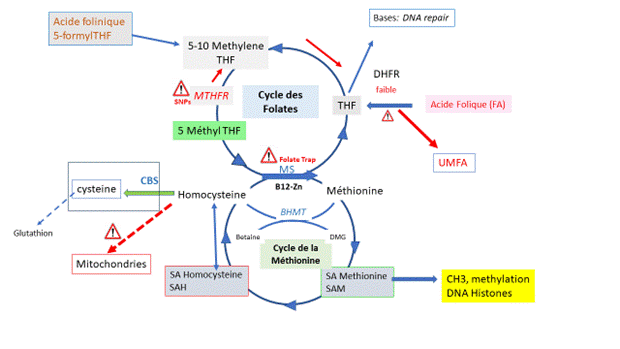
Figure 1 : Les cycles des folates et de la méthionine : implication dans les processus de méthylation/empreinte/épigénèse. L’acide Folique de synthèse peine à entrer dans le cycle des folates. Chez les porteurs des isoformes de la MTHFR, un deuxième obstacle intervient à ce niveau. L’accumulation d’acide folique non métabolisé entraine des inhibitions (Michaelis et Menten), par excès de substrat, de la DHFR, Dihydrofolate réductase qui va bloquer les récepteurs de l’acide folique naturel le 5MTHF. Les cellules vont alors se trouver dans une situation ou le métabolisme des folates sera totalement bloqué induisant une carence en donneurs de méthyl. Les flèches rouges indiquent une réversion/inhibition
Pourquoi est-il indispensable de tester l’homocystéinémie en préconceptionel :
Hyperhomocystéinémie et qualité des gamètes
Le « Rotterdam periconception Cohort » [9] confirme nos travaux et indique que l’homocysteine est un marqueur primordial de santé maternelle. L’hyperhomocystéinémie représente un réel danger pour la santé de la mère et est source de problèmes postnataux. « “routine analysis of homocysteine levels should be tested in preconception and pregnant women and their partners”. L ‘homocystéinémie doit être évaluée en routine chez les deux membres de couples en désir d’enfant(s). Comme nous l’avions indiqué, la méthylation est un paramètre important de la qualité/intégrité des gamètes, et postérieurement de l’intégrité embryonnaire, du fait de risques potentiels pour l’empreinte et la transmission épigénétique. Il ne faut pas négliger la possibilité de dommages à l’ADN.
Pour le sperme, il n’y a même plus débat : l’Hcy et sa forme réactive, Hcy thiolactone contribue fortement à la dégradation de la qualité et de la compétence du sperme [10], dégradation augmentant fortement avec l’âge [11,12] (du fait d’une moindre résistance au stress oxydant). Hcy est un poison des mitochondries [13], l’impact sur le sperme est simplement évident.
Chez la femme, le rétablissement final du marquage épigénétique de l’ADN et des histones est réalisée durant les dernières étapes de la maturation, immédiatement avant l’ovulation. Il se produit une demande brutale de groupement méthyl dans l’ovaire, surtout lors d’une hyperstimulation contrôlée [14] ; dans les conditions normales de régénération de Hcy, le processus est déjà extra-physiologique et +/- maitrisée. Une Hyperhomocystéinémie provoquera une rupture voire une inhibition du processus de méthylation du fait d’une très forte augmentation d’homocystéine dans le liquide folliculaire, connu pour affecter sévèrement la qualité ovocytaire [15,16]. La supplémentation avec le 5 Methyltetrahydrofolate (5MTHF), cofacteur de la méthionine synthase, en aval du blocage MTHFR, combiné à un support du cycle de la méthionine (Impryl R) est un très bon exemple ; elle améliore très significativement la formation de blastocystes [17,18], chez l’humain et le bovin. Le liquide folliculaire doit, autant que faire se peut, être débarrassé de son Hcy. L’implication de l’homocystéine dans la dégradation des mitochondries là encore pose problème (comme pour le sperme) et ne peut être négligée ; la transmission des mitochondries dans l’embryon étant essentiellement maternelle ; il est essentiel que la qualité de celles-ci soit préservée, afin d’éviter une implication potentielle dans les pathologies mitochondriales.
Hyperhomocystéinémie, grossesse et accouchement
Il est dorénavant clairement établi que l’hyperhomocystéinémie est un inducteur majeur de problèmes gestationnels et obstétricaux. Au-delà des problèmes de fermeture du tube neural (NTDs [19,20]), on observe des problèmes de défauts de croissance embryonnaire puis fœtale [19]. La littérature scientifique abonde de communications sur l’implication de l’Hyperhomocystéinémie sur l’hypertension maternelle, la prééclampsie, des arrêts de croissance fœtale …etc. Dans le domaine obstétrical, on peut citer accouchements prématurés, Apgar faible chez l’enfant, mortalité embryonnaire et maternelle anormalement élevées [19]. Les conséquences néfastes sur le développement et la maturation de cerveau sont documentées [21]. D’un point de vue heuristique les voies biochimiques maternelles sont, chez la mère, majoritairement orientées vers une baisse de l’homocysteine dans l’environnement embryonnaire et fœtal ; ainsi les estrogènes activent fortement la voie du CBS (Cystathionine Beta synthase, voir figure), qui active la formation de cystine (puis éventuellement de glutathion) à partir de l‘homocysteine. Aussi est-il important de se focaliser sur des traitements des réserves endogènes de folates « actifs » avant puis pendant la grossesse.
Traitements préconceptionels : Acide Folique (FA), acide folinique (FLA) ou 5-MethylTHF ?
Il est absolument évident que le métabolisme de ces composés est très rarement/jamais pris en compte. L’acide folique a une assez faible capacité à entrer dans le cycle des folates [22]. Il se produit alors une accumulation d’acide folique non métabolisé qui perturbe la régulation des cycles des folates et de la méthionine. Pour les porteurs des isoformes (variants) de la MTHFR le problème est sérieusement aggravé [24.25].
Femme
Hhcy est chez la femme majoritairement liée à la présence des isoformes de la MTHFR (surtout C677T [8]). Les traitements pour faire baisser l’homocysteine doivent être évalués précisément : l’acide folique, l’acide folinique et le 5 Méthyl THF ont des métabolismes spécifiques, et une activité totalement différente [23] vs Hhcy. Avant d’entrer dans le cycle des folates, l’acide folique (FA) doit être réduit en deux étapes par une enzyme la DHFR (DiHydroFolate Réductase) THF, TetraHydroFolate. Mais cette enzyme a régulièrement une activité faible chez les humains [22], il se produit une accumulation de FA non métabolisé qui a des effets délétères assez bien argumentés : l’UMFA (Un-Metabolised Folic Acide) peut provoquer un pseudo blocage du cycle MTHFR, avec montée d’homocystéine [25] ; mais aussi et peut être plus grave une saturation des récepteurs/transporteurs à l’acide folique naturel, le 5MTHF, empêchant son entrée dans les cellules. On assiste alors à une carence totale en folates du fait d’une absence de perméation de tous les folates dans les cellules. D’autre part, a vitamine B12 est un cofacteur nécessaire à l’activité de la Méthionine synthase : une éventuelle malabsorption fera monter Hhcy, même en présence de 5 MTHF [26] : c’est le syndrome de la Trappe a Folates (Folates trap). Dans ce cas, tous les folates sont bloqués ; il ne se produit plus de reformation de THF (voir figure) qui induit un affaissement du « DNA repair ». Le MTHF ne masque pas le syndrome de la trappe a folates, ainsi toute situation dans laquelle Hhcy ne baisse pas sous 5MTHF associé à un support des cycles des folates et de la méthionine, (Impryl R, Parthenogen CH), la vitamine B12 sanguine devra être dosée et la patiente traitée avec de forte dose de vitamine B12 (physio B12, Nutrixeal, Fr) [26]. Le 5 MTHF est efficace à doses physiologiques. L’acide folinique n’a pas dans ce cas d’intérêt pour faire baisser Hhcy, il est métabolisé en amont du goulot d’étranglement de la MTHFR. Sachant encore une fois que les isoformes de la MTHFR peuvent réduire son activité jusqu’à 50-70%
Homme
Il est curieux, que ce paramètre ait été longtemps ignoré alors que c’est pour l’homme que les montée d’Hhcy sont les plus fortes [8]. Il est dorénavant bien argumenté que Hcy affecte sévèrement la spermatogénèse [10] ; le sperme sera alors à l’origine de pathologies chez l’enfant [27], notamment d’anomalies de développement. Il n’est pas anormal que, du fait du rôle inhibiteur de méthylation de l’homocystéine, la spermatogénèse, qui est un processus continu, soit affectée par Hhcy. La méthylation est incontournable pour assurer la capacité du spermatozoïde à être fécond et plus important, sa capacité à assurer un développement embryonnaire à terme harmonieux [10,28]. L’importance de la qualité du méthylome du spermatozoïde, qui assure la transmission du marquage épigénétique et d’empreinte, est dorénavant devenue un dogme. L’Hhcy chez l’homme pourra causer chez l’enfant des défauts de fermeture du tube neural [27]. Le traitement avec de fortes doses d’acide folique, n’est pas approprié. Il aggrave les perturbations du méthylome [24] et augmente la quantité de l’UMFA (acide folique non métabolisé) circulant avec les conséquences négatives associées. Le 5 MTHF associé au support du cycle de la méthionine (Impryl R, CH, Tetrafolic R, Fr) permet de réduire le taux d’homocystéine circulant [28]. Par ailleurs, il faut noter que de trop fortes doses d’acide folique, pendant la grossesse, associées à un syndrome UMFA, pourraient être inductrices de défauts de spermatogénèse [29-31] dans l’embryon male, liés à la sursaturation des récepteurs au folate naturel, le 5MTHF
Impact de l’hyperhomocystéinémie des parents chez le nourrisson puis l’enfant : relation avec les isoformes MTHFR
La communauté scientifique est maintenant unanime reconnaitre que l’Hhcy peut avoir un impact sévère chez les parents puis leurs enfants. De plus, la transmission du statut MTHFR est bien sur une source de préoccupation [4, 9, 19, 20,]. Au-delà des effets comme les défauts de fermeture du tube neural, des pathologies cardiaques congénitales (CHD), fentes labiales/palatines (NOC), le syndrome de Down, l’Hhcy est aussi associées à des pathologies neurocognitives et cérébro-vasculaires, et potentiellement aux maladies de Parkinson et d’Alzheimer chez l’adulte. L’Hhcy est également responsable de la transmission de pathologies du métabolisme, des yeux et des reins. La méthylation de l’ADN est un facteur de stabilité du génome [32]. Une méthylation aberrante est source de prolifération cellulaire incontrôlée, menant à une tumorigénicité [1]. Une importante proportion des pathologies liées au stress oxydatif a en commun une homocystéine élevée. Tester l’homocystéinémie des parents et des enfants et, en cas de doute les MTHFR SNPS, est une stratégie importante de bonne pratique médicale. Des traitements très précoces avec le 5 MTHF, participera à cette bonne pratique médicale, afin d’éviter des problèmes/pathologies qui se développeront plus ou moins tard, avec les conséquences dramatiques associées.
Homocystéinémie : quelles valeurs « normales » ?
Les limites physiologiques de l’Hcy circulante sont estimées à 11.5 μM/L chez l’homme et à 8.5 μM/L chez la femme [3]. Cette différence observée dans les taux de base entre hommes et femmes est liée à la voie d’élimination de l’homocystéine en Cystine (qui ne permet pas la régénération de l’homocystéine en Méthionine). Cette voie Cystathionine beta synthase (CBS), est activée par les estrogènes et inhibée par les androgènes. Chez le nourrisson et l’enfant impubère, l’homocystéinémie doit être inférieure ou égale à 7 μM/L
Chez l’adulte, toute augmentation de 2.5 μM/L, conduit à un accroissement des risques cardio et neuro vasculaire de 10%. Une valeur supérieure à 20 μM/L, multiplie ces risques par 9 [33] ; les risques sont donc exponentiels. De fait, toute homocystéinémie supérieure à 15 μM/L doit être considérée comme réellement a risque, surtout chez la femme.
La littérature scientifique indique aucune anomalie/pathologie liée à des valeurs faibles d’homocystéine circulante.
A noter que le gène CBS (cystathionine beta synthase) est situé sur le chromosome 21 ; il est surexprimé chez les porteurs de la trisomie 21, ainsi logiquement l’homocystéinémie est très faible. [34]
De la nécessité d’un conseil génétique….
L’analyse de l’homocystéinémie et des MTHFR SNPs, a permis grâce au traitement, de régler de nombreux problèmes d’infertilité, certains de très longue durée, associés ou non à des fausses couches à répétition, le plus souvent classifiés « idiopathiques », et parfois après un nombre conséquent d’échecs de FIV, voire même de dons d’ovocytes [35-37].
Deux éléments sont à prendre en compte dans la prise en charge de ces couples présentant ces types d’infertilité :
*La possibilité, grâce à ces diagnostics et aux traitements, d’obtenir la naissance d’enfants mais potentiellement porteurs des MTHFR SNPs sous diverses formes
*L’hyperhomocystéinémie détectée chez un des membres du couple infertile comme porte d’entrée à la recherche de différentes pathologies dans la famille du cas index.
Pour ces deux raisons majeures et compte tenu de l’efficacité réelle et de l’innocuité des traitements, y compris et surtout chez l’enfant [38], le conseil génétique est souhaitable, voir indispensable, en soutien des parents, pour leur santé et celle de leurs enfants.
Conclusions
L’homocystéine sérique est le miroir des processus ubiquitaires de méthylation de l’organisme. Comme indiqué précédemment, des anomalies de méthylation/épigénèse dans le métabolisme général, jouent un rôle significatif dans la genèse de nombreuses pathologies [33,39]. De façon cruciale, ces anomalies qui peuvent avoir un impact dramatique lors du développement embryonnaire, puis postnatal sont largement réversibles si leurs sources (cycles de la méthionine et des folates) sont détectées en préconceptionel (homocystéinémie et MTHFR SNPs). Dans une récente publication, Yverneau et al. [4], ont décrit les impacts dramatiques de ces problèmes.
Clairement, la mise en évidence, en postnatal, des anomalies des deux cycles impliqués et de leurs conséquences neurocognitives et végétatives, est bien trop tardive, pour y apporter quelques améliorations, sinon un soulagement superficiel. Les « dégâts » se retrouveront inéluctablement, à plus ou moins longs termes. (40).
La détection des risques potentiels, bien en amont de la grossesse permettrait d’éviter le fardeau des maladies métaboliques (entre autres) pour les parents et les enfants. Cette observation/fonctionnalité a été reconnue par notre groupe depuis 2018 ; l’hypofertilité est une porte d’entrée dans le diagnostic d’autres pathologies chez les couples infertiles et de leurs enfants.
Les couples en désir d’enfants sont testés pour l’homocystéinémie et éventuellement les 2 principales isoformes de la MTHFR C677T et A1298C. Les traitements au 5 MTHF (Impryl R, Tetrafolic R), adossé à un support du cycle de la méthionine, notamment la Méthyl cobalamine afin d’éviter le syndrome de la trappe a folates (liée à la mauvaise capacité d’absorption de la vitamine B12) et la bétaïne, sont très efficaces pour baisser l’homocystéine sanguine.[28]. Il est par ailleurs possible que, dans certains cas, la prise continue, toute la vie, de ces compléments soit recommandée. Ceci afin d’améliorer/assurer la qualité de vie des enfants, et de leur éviter des pathologies aux conséquences dramatiques.
Des doses massives d’acide folique sont parfois prescrites en preconceptionel et pendant la grossesse ; l’apparition du syndrome UMFA (Unmetabolized Folic acid Syndrome), est maintenant clairement établi ; sa présence pose dorénavant question quant à la santé des enfants et des mères [23], mettant en cause le principe de « fortification » présent dans les pays anglo-saxons, consistant à enrichir farines et céréales en Acide Folique. [41,42].
Il est à noter une différence de prise en charge dans d’autres pays :
- Les assurance santé aux USA, réputées pour être très restrictives, remboursent le dosage de l’homocystéine, sur demande des cliniciens.
- L’Italie est très avancée sur le dépistage sur le dépistage MethylMalonic Acid (MMA) et Hcy (maladies liées aux aminoacides) chez le nourrisson : https://www.osservatorioscreening.it/screening-neonatale-malattie-metab…
Deux facteurs majeurs de la vie moderne ont de plus un impact négatif quant à la transmission aux futures générations d’erreurs d’empreinte et d’épigénèse, liée à la méthylation. L’augmentation de l’âge des futurs parents, indépendamment ou non de la recomposition des familles, diminue la résistance au stress oxydant, ce qui augmente les risques d’erreurs d’empreinte et de marquage épigénétique. [12,43]
Les perturbateurs endocriniens [EDCs) sont maintenant présents dans tous les liquides biologiques tant masculins que féminins : liquide séminal, liquide folliculaire, placenta. Ces composés interfèrent négativement avec les processus de méthylation : les erreurs ainsi induites sont alors transmises de générations en générations [43,44].
Du fait de toutes les observations citées ici nous sommes en accord total avec les recommandations du « Rotterdam Periconception Cohort » : l’homocystéinémie doit être évaluée chez tous les couples (les deux partenaires) en désir d’enfants et doit être une pièce maitresse/incontournable du bilan d’infertilité !
La détection précoce de l’Hyperhomocystéinémie, avec les traitements appropriés contenant du 5 MTHF [38] si nécessaire, doit être considérée comme de la bonne pratique médicale, en vue de la protection infantile, afin de maintenir les enfants en bonne santé et d’éviter dans le futur certaines pathologies lourdes.
_______________________________
1-Farsetti A, Illi B, Gaetano C. How epigenetics impacts on human diseases. Eur J Intern Med. 114, 15–22 (2023).
2. Kelly TL, Trasler JM. Reproductive epigenetics. Clin. Genet. 65(4), 247–260 (2004).
3-Clement A, Alvarez S, Jacquesson-Fournols L et al. Women are More Protected than Men against HHcy (Hyperhomocysteinemia)during their Reproductive Life: Gender-Related Differences in One- Carbon and Folate Cycles Metabolism. Arch. Clin. Biomed. Res. 7, 345–352(2023).
4- Yverneau M, Leroux S, Imbard A et al. Influence of early identification and therapy on long-term outcomes in early-onset MTHFR deficiency. J. Inherit. Metab. Dis. 45(4), 848–861 (2022).
5- Menezo Y, Khatchadourian C, Gharib A et al. Regulation of S-adenosyl methionine synthesis in the mouse embryo. Life Sci.;44(21):1601-9.(1989)
6. Chen NC, Yang F, Capecci LM et al. Regulation of homocysteine metabolism and methylation in human and mouse tissues. FASEBJ. 24(8), 2804–2817 (2010).
7 James SJ, Melnyk S, Pogribna M, Pogribny IP, Caudill MA. Elevation in S adenosylhomocysteine and DNA hypomethylation: potential epigenetic mechanism for homocysteine-related pathology. J Nutr. 132(Suppl. 8), S2361–S2366 (2002).
8- Clément A, Alvarez S, Jacquesson-Fournols L et al. Women are More Protected than Men against Hhcy (Hyperhomocysteinemia) during their Reproductive Life: Gender-Related Differences in One-Carbon and Folate Cycles Metabolism. Archives of Clinical and Biomedical Research. 2023, 7: 345-352.
9- Rubini E, Snoek KM, Schoenmakers S et al. First Trimester Maternal Homocysteine and Embryonic and Fetal Growth: The Rotterdam Periconception Cohort. Nutrients. 14(6), 1129 (2022).
10-Aitken R.J., Flanagan H.M., Connaughton H et al. Involvement of homocysteine, homocysteine thiolactone, and paraoxonase type 1 (PON-1) in the etiology of defective human sperm function. Andrology, 4:345-60. (2016)
11-Aston KI, Uren PJ, Jenkins TG et al. Aberrant sperm DNA methylation predicts male fertility status and embryo quality. Fertil Steril. 104(6), 1388–1397 (2015).
12-. Ashapkin V, Suvorov A, Pilsner JR et al. Age-associated epigenetic changes in mammalian sperm: implications for offspring health and development. Hum Reprod Update. 29(1), 24–44 (2023).
13- Zhang T, Huang D, Hou J et al. High concentration homocysteine inhibits mitochondrial respiration function and production of reactive oxygen species in neuron cells. Cerebrovasc Dis. 29(10), 105109 (2020).
14 Menezo Y, Elder K, Clément P et al.. Biochemical Hazards during Three Phases of Assisted Reproductive Technology: Repercussions Associated with Epigenesis and Imprinting. Int J Mol Sci. 23(16) :8916. (2022)
15-Boxmeer JC, Macklon NS, Lindemans J et al. IVF outcomes are associated with biomarkers of the homocysteine pathway in monofollicular fluid. Hum. Reprod. 24(5), 1059–1066 (2009).
16. Berker B, Kaya C, Aytac R, Satiroglu H. Homocysteine concentrations in follicular fluid are associated with poor oocyte and embryo qualities in polycystic ovary syndrome patients undergoing assisted reproduction. Hum. Reprod. 24(9), 2293–2302 (2009).
17- Kucuk T, Horozal PE, Karakulak A,et al. Follicular homocysteine as a marker of oocyte quality in PCOS and the role of micronutrients. J Assist Reprod Genet.;40(8):1933-1941. (2023)
18- Golestanfar A, Niasari-Naslaji A, Jafarpour F et al. Metabolic enhancement of the one carbon metabolism (OCM) in bovine oocytes IVM increases the blastocyst rate: evidences for a OCM checkpoint. Sci Rep. ;12(1):20629. (2022)
19-Dai C, Fei Y, Li J, Shi Y, Yang X. A Novel Review of Homocysteine and Pregnancy Complications. Biomed Res Int. 6652231 (2021).
20-. Yu Y, Jia C, Shi Q, Zhu Y, Liu Y. Hyperhomocysteinemia in men with a reproductive history of fetal neural tube defects: three case reports and literature review. Medicine 98(2), e13998 (2019).
21-Vasilev DS, Shcherbitskaia AD, Tumanova NL et al. Maternal Hyperhomocysteinemia Disturbs the Mechanisms of Embryonic Brain Development and Its Maturation in Early Postnatal Ontogenesis. Cells ;12(1):189. (2023)
22- Bailey S & Ayling JE The extremely slow and variable activity of dihydrofolate reductase in human liver and its implications for high folic acid intake. Proc. Natl. Acad. Sci. USA ; 106, 15424–15429. (2009)
23- Menezo Y, Elder K, Clément A et al. Folic Acid, Folinic Acid, 5 Methyl TetraHydroFolate Supplementation for Mutations That Affect Epigenesis through the Folate and One-Carbon Cycles. Biomolecules 12(2), 197 (2022).
24- Aarabi M, San Gabriel MC, Chan D et al. High-dose folic acid supplementation alters the human sperm methylome and is influenced by the MTHFR C677Tpolymorphism. J. Hum. Mol. Genet. 24(22), 6301–6313 (2015).
25- Cornet D, Clement A, Clement P et al. High doses of folic acid induce a pseudo-methylenetetrahydrofolate syndrome. SAGE Open Med Case Rep.; 7:205031 (2019)
26-Clément A, Clément P, Viot G et al. -The importance of preconception Hcy testing: identification of a folate trap syndrome in a woman attending an assisted reproduction program. J Assist Reprod Genet. ;40(12):2879-2883 (2023)
27-Yu Y, Jia C, Shi Q, Zhu Y, Liu Y. Hyperhomocysteinemia in men with a reproductive history of fetal neural tube defects: three case reports and literature review. Medicine 98(2), e13998 (2019).
28- Clément A, Amar E, Clément P et al. .Hyperhomocysteinemia in hypofertile male patients can be alleviated by supplementation with 5MTHF associated with one carbon cycle support. Front Reprod Health ;5 :1229997 (2023)
29- Menezo Y, Clément P, Elder K.Are UMFA (un-metabolized folic acid) and endocrine disruptor chemicals (EDCs) co-responsible for sperm degradation ? An epigenetic/methylation perspective. Andrologia; 54(6): e14400. (2022)
30- Ly L , Chan D , Aarabi, M. et al. Intergenerational impact of paternal lifetime exposures to both folic acid deficiency and supplementation on reproductive outcomes and imprinted gene methylation. Molecular Human Reproduction, 23(7), 461‐477. (2017)
31-Ly, L. , Chan, D. , & Trasler, J. Developmental windows of susceptibility for epigenetic inheritance through the male germline. Seminars in Cell & Developmental Biology, 43, 96‐105 (2015)
32- Yverneau M, Leroux S, Imbard A et al. Influence of early identification and therapy on long-term outcomes in early-onset MTHFR deficiency. J. Inherit. Metab. Dis. 45(4), 848–861 (2022).
33- Duthie S, Narayanan S, Brand G, et al. Impact of folate deficiency on DNA stability. J. Nutr 132: 2444S–2449S, (2002)
34- Servy EJ, Jacquesson-Fournols L, Cohen M, Menezo YJR. MTHFR isoform carriers. 5-MTHF (5-methyl tetrahydrofolate) vs folic acid: a key to pregnancy outcome: a case series.J Assist Reprod Genet.35(8):1431-1435 (2018)
35- Jacquesson-Fournols L, Alvarez S, Cohen M et al. A paternal effect of MTHFR SNPs on gametes and embryos should not be overlooked: case reports. J Assist Reprod Genet. 36(7):1351-1353. (2019)
36- Goyco Ortiz LE, Servy EJ, Menezo YJR. A successful treatment with 5 methyltetrahydrofolate of a 677 TT MTHFR woman suffering premature ovarian insufficiency post a NHL (non-Hodgkin's lymphoma) and RPL (repeat pregnancy losses).J Assist Reprod Genet.;36(1):65-67 (2019)
37-Troesch B, Demmelmair J, Gimpfl M, et al. MEFOLIN Study Group. Suitability and safety of L-5- methyltetrahydrofolate as a folate source in infant formula: A randomized-controlled trial. PLoS One;14:e0216790.(2019)
38- Škovierová H, Vidomanová E, Mahmood S et al. The Molecular and Cellular Effect of Homocysteine Metabolism Imbalance on Human Health. Int J Mol Sci. ;17(10):1733. (2016)
39- Zarembska E, Slusarczyk K, Wrzosek M The Implication of a Polymorphism in the Methylenetetrahydrofolate Reductase Gene in Homocysteine Metabolism and Related Civilisation Diseases. Int.J. Mol. Sci.; 25, 193. (2024)
40- House SH, Nichols JA, Rae S. Folates, folic acid and preconception care - a review. JRSM Open;12(5):2054270420980875 (2021)
41-Maruvada P, Stover PJ, Mason et al. Knowledge gaps in understanding the metabolic and clinical effects of excess folates/folic acid: a summary, and perspectives, from an NIH workshop. Am J Clin Nutr. 2020 ;112(5):1390-1403. [2020]
42- Menezo YJ, Silvestris E, Dale B et al. Oxidative stress and alterations in DNA methylation: two sides of the same coin in reproduction..Reprod Biomed Online.;33(6):668-683. (2016)
43-Manikkam M, Tracey R, Guerrero-Bosagna C et al Plastics derived endocrine disruptors (BPA, DEHP and DBP) induce epigenetic transgenerational inheritance of obesity, reproductive disease and sperm epimutations. PLoS One.;8(1): e55387. (2013)





